Primovist 0,25 mmol/ml injektionsvätska, lösning i förfylld spruta
dinatriumgadoxetat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du ges detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information. Du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare som ger dig Primovist.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Primovist är ochvad det används för
- Vad du behvöer veta innan du ges Primovist
- Hur du använder Primovist
- Eventuella biverkningar
- Hur Primovist ska förvaras
- Förpackningens innehåll och övriga upplysningar
1. Vad produkten är och vad den används för
Primovist är ett kontrastmedel för magnetudersökning (MRT) av levern. Preparatet används för att avbilda och diagnosticera eventuella förändringar i levern. Det är möjligt att göra en mer noggrann bedömning av onormala förändringar i levern (avseende mängd, storlek och läge) med hjälp av preparatet. Primovist bidrar också till säkrare diagnoser då läkaren med hjälp av preparatet kan fastställa vilken typ av onormala förändringar som påträffats. Preparatet tillhandahålls som en intravenös injektion. Detta läkemedelspreparat är endast avsett för diagnostiskt bruk.
Magnetundersökning är ett diagnostiskt undersökningssätt där man utnyttjar vattenmolekylernas olika sätt att uppträda dels i normala, dels i sjukliga vävnader. Avbildning sker genom en komplex sammanställning av magnet- och radiovågor.
2. Vad du behöver veta innan produkten används
Använd inte Primovist
- om du är allergisk mot dinatriumgadoxetat eller något annat innehålsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare innan du ges Primovist, om du
- har eller har haft astma eller allergi så som hösnuva, nässelfeber
- tidigare har reagerat mot kontrastmedel
- har nedsatt njurfunktion. Hos patienter med nedsatt njurfunktion har användningen av vissa kontrastmedel som innehåller gadolinium konstaterats ha ett samband med nefrogen systemisk fibros (NSF). NSF är en sjukdom som förorsakar förtjockning av huden och bindvävnaden och kan leda till funktionshämmande orörlighet i lederna, muskelsvaghet eller eventuellt livshotande nedsatt funktion i de inre organen
- har en allvarlig hjärt- eller kärlsjukdom
- har låg kaliumhalt i blodet
- eller en familjemedlem till dig har haft problem med hjärtrytmen (långt QT-syndrom)
- haft påverkan på hjärtrytm vid användning av preparatet
- har en pacemaker eller anna typ av implant eller clips som innehåller järn i din kropp.
Allergiliknande reaktioner kan förekomma efter användning av Primovist med fördröjda reaktioner efter timmar eller dagar. Se avsnitt Eventuella biverkningar.
Tala om för läkare om:
- dina njurar inte fungerar normalt.
- du nyligen har har genomgått eller snart förväntas att genomgå en levertransplantation.
Läkare kan besluta att ta blodprov för att undersöka hur dina njurar fungerar innan beslut tas om användning av Primovist, speciellt om du är 65 år eller äldre.
Ackumulering i kroppen
Primovist fungerar eftersom det innehåller metallen gadolinium. Studier har visat att små mängder gadolinium kan stanna kvar i kroppen, inklusive hjärnan. Inga biverkningar på grund av kvarvarande gadolinium i hjärnan har setts.
Barn och ungdomar
Säkerhet och effekt för Primovist har inte fastställts hos patienter under 18 år då erfarenheten av dess användning är begränsad. Ytterligare information om användning av Primovist hos barn ges i slutet av denna bipacksedel.
Andra läkemedel och Primovist
Tala om för läkare om du använder, nyligen har använt eller kan tänkas använda andra läkemedel. Särskilt gäller detta för:
- betablockerare, läkemedel som används för behandling av förhöjt blodtryck eller andra hjärtsjukdomar
- läkemedel som påverkar hjärtrytmen eller pulsen så som amiodaron, sotalol
- rifampicin, läkemedel som används för behandling av tuberkulos eller vissa andra infektioner.
Graviditet och amning
Graviditet
Du måste tala om för läkare om du tror att du är eller kan bli gravid eftersom Primovist inte ska användas under graviditet om det inte är absolut nödvändigt.
Amning
Tala om för läkare om du ammar eller ska börja amma. Läkare kommer att diskutera med dig om du bör fortsätta eller avbryta amning under en period av 24 timmar efter du har fått Primovist.
Körförmåga och användning av maskiner
Primovist har ingen eller försumbar effekt på förmågan att framföra fordon eller använda maskiner.
Primovist innehåller natrium
Detta läkemedel innehåller 82 mg natrium (huvudkomponenten i bordsalt) per dos baserat på genomsnittliga dosen till en patient som väger 70 kg. Detta motsvarar 4,1 % av det högsta rekommenderade dagliga intaget av natrium för vuxna.
3. Hur produkten används
Primovis injiceras i en ven med en liten nål. Primovist injiceras strax före en magnetkameraundersökning.
Du kommer att observeras under minst 30 minuter efter injektionen.
Rekommenderad dos är
0,1 ml Primovis per kg kroppsvikt.
Dosering i särskilda patientgrupper
Användning av Primovist rekommenderas inte till patienter med allvarliga njurproblem och till patienter som nyligen har genomgått eller snart förväntas genomgå en levertransplantation. Om användning trots allt är nödvändig ska du endast få en dos av Primovist under en undersökning och du ska inte få en andra injektion innan det gått minst 7 dagar.
Äldre
Det är inte nödvändigt att anpassa dosen om du är 65 år eller äldre men du kan behöva ta ett blodprov för att undersöka hur bra dina njurar fungerar.
Om du får för stor mängd av Primovist
Det är osannolikt med överdosering. Skulle detta ändå inträffa tar läkare hand om eventuella symtom.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
De flesta av biverkningarna är lindriga eller måttliga.
Om du får biverkningar, tala med din läkare.
Liksom för andra kontrastmedel kan i sällsynta fall allergiska reaktioner förekomma. Fördröjda reaktioner kan uppträda timmar eller dagar efter du har fårr Primovist.
Den allvarligaste biverkningen hos patienter som får Primovist är anafylaktisk chock (en allvarlig allergiliknande reaktion).
Kontakta omedelbart läkare om du upplever följande symtom eller har andningssvårigheter:
- lågt blodtryck
- svullnad av tunga, hals eller ansikte
- rinnande näsa, nysningar, hosta
- röda, rinnande och kliande ögon
- magsmärta
- nässelutslag
- minskad känsel eller känslighet i huden, klåda, blekhet
Andra biverkningar som kan förekomma:
Vanliga: kan förekomma hos upp till 1 av 10 anvädare
Mindre vanliga: kan förekomma hos upp till 1 av 100 användare
- svindel
- yrsel
- domning och stickningar
- smak- och luktförändrigar
- rodnad
- förhöjt blodtryck
- andningssvårigheter
- kräkningar
- muntorrhet
- hudutslag
- svår klåda, över hela kroppen eller kliande ögon
- rygg- eller bröstsmärta
- reaktioner vid injektionsstället såsom brännande känsla, köldkänsla, irritation eller smärta
- värmekänsla
- frossa
- trötthet
- "kontig känsla"
Sällsynta: kan förekomma hos upp till 1 av 1000 användare
- oförmåga att sitta eller stå stilla
- darrningar
- hjärtklappning
- oregelbunden hjärtrytm (tecken på grenblock)
- (överledningsstörningar i hjärtat)
- obehag i munnen
- ökad salivutsöndring
- röfa hudutslag som består av fläckar och blemmor
- ökad svettning
- obehagkänsla, allmän sjukdomskänsla
Har rapporterats: förekommer hos ett okänt antal användare
- snabba hjärtslag
- rastlöshet.
Förändrade laboratorievärden kan förekomma en kort tid efter du har fått Primovist. Informera vårdpersonalen om du nyligen har fått Primovist och ska lämna blod- eller urinprover.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan).
Webbplats: www:fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
5. Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på sprutans eller ytterkartongens etikett efter Exp. Utgångsdatumet är den sista dagen i angiven månad.
Detta läkemedel krävs inga särskilda förvaringsanvisningar.
Detta läkemedel ska administreras direkt efter öppnandet.
Läkemdel ska inspekteras visuellt före användning. Använd inte detta läkemedel i fall av allvarlig missfärgning, synliga partiklar eller skadad förpackning.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonal hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är dinatriumgadoxetat. 1 ml innehåller 0,25 mmol dinatriumgadoxetat (motsvarande 181,43 mg dinatriumgadoxetat).
- Övriga innehållsämnen är trinatriumcaloxetat, trometamol, natriumhydroxid och saltsyra (båda för pH-justering), vatten för injektionsvätskan.
1 förfylld spruta med 5,0 ml innehåller 907 mg dinatriumgadoxetat,
1 förfylld spruta med 7,5 ml innehåller 1361 mg dinatriumgadoxetat, [endast förfyllda glassprutor]
1 förfylld spruta med 10,0 ml innehåller 1814 mg dinatriumgadoxetat.
Läkemedlets utseende och förpackningsstorlekar
Primovist är en klar, färglös eller ljusgul lösning utan synliga partiklar. Förpackningarna innehåller 1, 5 eller 10 fröfyllda sprutor med:
5,0 ml injektionsvätska (i förfyllda glas-/eller plastsprutor om 10 ml)
7,5 ml injektionsvätska (i förfyllda glassprutor om 10 ml) [endast förfyllda glassprutor]
10,0 ml injektionsvätska (i förfyllda glas- /eller plastsprutor om 10 ml)
Det är möjligt att samtliga förpackningsstorlekar inte finns till salu.
Innehavare av godkännande för försäljning, marknadsförare och tillverkare
Innehavare av godkännande för försäljning
Bayer Oy, Pansiovägen 17, 20210 Åbo, Finland
Marknadsförare
Bayer Oy, PB 73, 02151 Esbo, Finland
Telefon 020 785 21
Tillverkare:
Bayer AG, Müllerstrasse 178, 13353 Berlin, Tyskaland
Denna bipacksedel ändrades senast 30.10.2019
Direktiv för experterna inom hälsovården
• Nedsatt njurfunktion
Före administrering av Primovist rekommenderas att alla patienter undersöks med avseende på nedsatt njurfunktion med hjälp av laboratorieprover.
Rapporter om nefrogen systemisk fibros (NSF) har förekommit i samband med användning av vissa gadoliniuminnehållande kontrastmedel hos patienter med akut eller kronisk kraftigt nedsatt njurfunktion (GFR<30 ml/min/1,73 m2). Patienter som genomgår levertransplantation löper särskilt hög risk, eftersom incidensen av akut njursvikt är hög i denna grupp. Då det finns risk att NSF kan uppstå med Primovist, bör användning undvikas
- till patienter med kraftigt nedsatt njurfunktion
- i den perioperativa fasen av en levertransplantation
såvida inte den diagnostiska informationen är nödvändig och inte kan fås med icke-kontrastförstärkt MRT. Om användning av Primovist inte kan undvikas ska dosen inte överstiga 0,025 mmol/kg kroppsvikt. Fler än en dos ska inte användas under en undersökning. Eftersom information om upprepad administrering saknas ska injektioner med Primovist inte upprepas om inte intervallet mellan injektionerna är minst 7 dagar.
Eftersom renalt clearence av gadoxetat kan vara nedsatt hos äldre, är det speciellt viktigt att undersöka patienter som är 65 år och äldre med avseende på nedsatt njurfunktion.
Hemodialys kort tid efter administrering av Primovist kan vara till nytta för att avlägsna Primovist från kroppen. Det finns inga belägg som stödjer påbörjande av hemodialys för att förhindra eller behandla NSF hos patienter som inte redan genomgår hemodialys.
• Graviditet och amning
Primovist skall användas under graviditet endast då tillståndet innebär att det är absolut nödvändigt att kvinnan använder gadoxetat.
Om amning ska fortsätta eller avbrytas under en period av 24 timmar efter administrering av Primovist ska beslutas av läkaren och den ammande modern.
• Pediatrisk population
En observationsstudie utfördes hos 52 pediatriska patienter i åldern äldre än 2 månader och yngre än 18 år. Patienter remitterades för Primovist-förstärkt MRT av levern för att utvärdera misstänkta eller kända fokala leverlesioner. Ytterligare diagnostisk information erhölls när kombinerade icke-kontrastförstärkta och kontrastförstärkta MRI av levern jämfördes med enbart icke-kontrastförstärkta MRI. Allvarliga biverkningar rapporterades, men prövare bedömde att ingen var relaterad till Primovist. På grund av studiens retrospektiva karaktär och det lilla urvalet, kan ingen säker slutsats dras om effekt och säkerhet i denna population.
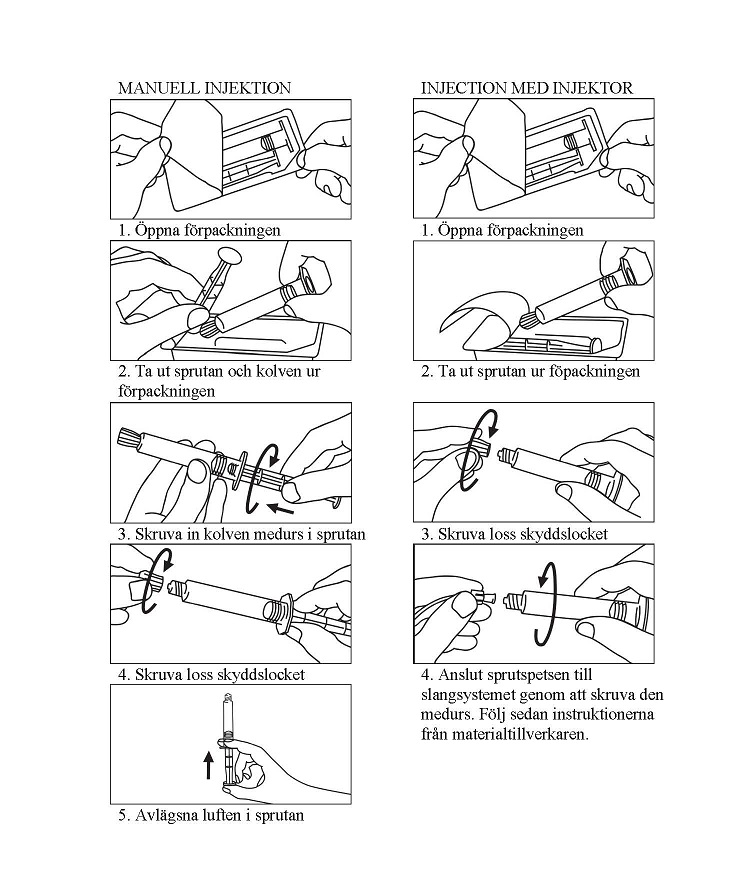
• Före injektion
Primovist är en klar, färglös eller ljusgul lösning utan synliga partiklar. Kontrastmedlet skall kontrolleras okulärt före användning. Primovist får inte användas om den fått kraftig färg, om den innehåller synliga partiklar eller om läkemedelsflaskan är skadad.
• Dosering
Primovist administreras utan spädning som en intravenös bolusinjektion med en ungefärlig hastighet på 2 ml/s. Venkanylen / slangen skall efter injektion spolas med steril, 0,9-procentig natriumkloridlösning (cirka 30 ml).
- Patienten skall observeras under minst 30 minuter efter injektionen.
- Primovist får inte blandas med andra läkemedelspreparat.
- Intramuskulär användning skall ovillkorligen undvikas.
• Hantering av preparatet
Primovist-injektionsvätskan är färdig för användning.
Förfylld spruta förbereds för injektion omedelbart före användning.
Skyddslocket skall avlägsnas omedelbart före användning.
Överbliven lösning i sprutan skall förstöras enligt lokalt regelverk.
Den avtagbara spårningsetiketten på sprutan ska fästas i patientjournalen för att möjliggöra noggrann dokumentering av vilket gadoliniuminnehållande kontrastmedel som använts. Dosen som använts ska också dokumenteras. Om en elektronisk patientdatabas används, bör produktens namn, satsnummer och dos föras in i patientdatabasen.
Glasspruta:
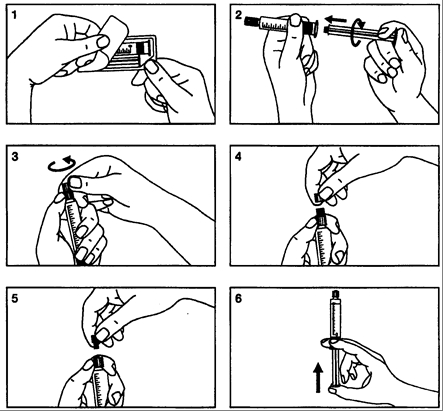
- Öppna förpackningen
- Skruva fast kolven på sprutan
- Bryt loss skyddslocket
- Avlägsna skyddslocket
- Avlägsna gummiproppen
- Töm sprutan på luft
Plastspruta: