Lucentis 10 mg/ml injektioneste, liuos, esitäytetty ruisku
ranibitsumabi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Lucentis on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Lucentis-valmistetta
3. Miten Lucentis-valmistetta annetaan
4. Mahdolliset haittavaikutukset
5. Lucentis-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Mitä Lucentis on?
Lucentis on silmään pistettäväksi tarkoitettu liuos. Lucentis kuuluu ns. uudissuonimuodostusta estävien lääkkeiden ryhmään. Lääkkeen sisältämän vaikuttavan aineen nimi on ranibitsumabi.
Mihin Lucentis-valmistetta käytetään?
Lucentis-valmistetta käytetään usean eri näkökyvyn heikkenemistä aiheuttavan silmäsairauden hoitoon aikuisilla.
Kyseiset sairaudet johtuvat verkkokalvon vaurioitumisesta (valoherkkä kerros silmän takaosassa):
- vuotavien, tavallisesta poikkeavien verisuonten muodostumisen seurauksena. Tätä havaitaan esim. ikään liittyvän kostean verkkokalvon makulan rappeuman (kostean AMD:n) ja proliferatiivisen diabeettisen retinopatian (PDR, diabeteksen aiheuttama sairaus) yhteydessä. Sitä voi ilmetä myös patologisesta likitaittoisuudesta (PM) johtuvan, verisuonia muistuttavien silmänpohjan juosteista (Angioid streaks) johtuvan tai keskeisestä seroosista korioretinopatiasta johtuvan silmän suonikalvon uudissuonittumisen (CNV) sekä tulehduksellisen silmän suonikalvon uudissuonittumisen (CNV) yhteydessä.
- makulaturvotuksen vuoksi (eli verkkokalvon keskiosan turvotuksen seurauksena). Tällainen turvotus voi aiheutua diabeteksesta (ns. diabeettinen makulaturvotus, DME) tai verkkokalvon laskimoiden tukkeutumisesta (kutsutaan verkkokalvon laskimotukokseksi, RVO:ksi).
Miten Lucentis toimii?
Lucentis tunnistaa ja sitoutuu silmässä täsmällisesti tiettyyn proteiiniin, jota kutsutaan ihmisen vaskulaarisen endoteelin kasvutekijäksi (VEGF-A). Liian suurina määrinä VEGF-A saa aikaan tavallisesta poikkeavien verisuonten kasvun ja voi aiheuttaa turvotusta silmässä, mikä puolestaan voi johtaa näkökyvyn heikkenemiseen esim. seuraavien sairauksien yhteydessä: ikään liittyvä kostea verkkokalvon makulan rappeuma (kostea AMD), diabeettinen makulaturvotus (DME), proliferatiivinen diabeettinen retinopatia (PDR), verkkokalvon laskimotukos (RVO), patologinen likitaittoisuus (PM) ja silmän suonikalvon uudissuonittuminen (CNV). Sitoutumalla VEGF-A:han Lucentis voi estää VEGF-A:n vaikutuksia ja ennaltaehkäistä edellä mainitun kaltaista epänormaalia kasvua ja turvotusta.
Yllä mainittujen sairauksien yhteydessä Lucentis voi edesauttaa näkökykysi säilymistä ja usein myös parantaa näkökykyäsi.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinun ei tule saada Lucentis-valmistetta
- jos olet allerginen ranibitsumabille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on tulehdus silmässä tai silmän ympärillä.
- jos silmäsi on kipeä tai punoittava (vakava silmän sisäinen tulehdus).
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin sinulle annetaan Lucentista.
- Lucentis annetaan injektiona silmään. Lucentis-injektion jälkeen voi esiintyä toisinaan silmän sisäosan tulehduksia, kipua tai punoitusta (tulehdus), yhden silmän takaosassa sijaitsevan kerroksen irtoamista tai repeytymistä (verkkokalvon tai verkkokalvon pigmenttiepiteelin irtoamista tai repeytymistä) tai linssin samentumista (kaihi). On tärkeää tunnistaa ja hoitaa tulehdukset tai verkkokalvon irtauma mahdollisimman pian. Kerro heti lääkärille, jos sinulla ilmenee sellaisia oireita kuin silmäkipu tai paheneva epämukavuuden tunne silmässä, paheneva silmän punoitus, näön sumentuminen/heikentyminen, pienten hiukkasten lisääntyminen näkökentässä tai lisääntynyt valonarkuus.
- Silmänpaine voi nousta osalla potilaista joksikin aikaa heti injektion jälkeen. Et ehkä huomaa silmänpaineen nousua, ja sen vuoksi lääkäri saattaa tarkkailla silmänpainetta jokaisen injektion jälkeen.
- Kerro lääkärille, jos sinulla on ollut silmäsairauksia aiemmin tai olet saanut hoitoa silmävaivaan, sekä jos sinulla on ollut aivohalvaus tai aivohalvaukseen viittaavia ohimeneviä oireita (raajojen tai kasvojen heikkoutta tai halvaus, puhevaikeuksia tai vaikeuksia ymmärtää puhetta). Nämä tiedot otetaan huomioon, kun arvioidaan Lucentis-hoidon sopivuutta sinulle.
Tarkemmat tiedot haittavaikutuksista, joita mahdollisesti voi esiintyä Lucentis-hoidon yhteydessä löytyvät kohdasta Mahdolliset haittavaikutukset (”Mahdolliset haittavaikutukset”).
Lapset ja nuoret (alle 18-vuotiaat)
Lucentis-valmisteen käyttöä lapsilla ja nuorilla ei ole varmistettu eikä käyttöä sen vuoksi suositella.
Muut lääkevalmisteet ja Lucentis
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
- Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä Lucentis-hoidon ajan sekä vähintään kolme kuukautta viimeisen Lucentis-pistoksen jälkeen.
- Lucentis-valmisteen käytöstä ei ole kokemusta raskaana olevilla naisilla. Lucentis-valmistetta ei saa käyttää raskauden aikana, elleivät hoidosta saatavissa olevat hyödyt ylitä mahdollisia syntymättömään lapseen kohdistuvia riskejä. Jos olet raskaana, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, keskustele asiasta lääkärin kanssa ennen Lucentis-hoitoa.
- Pieniä määriä Lucentis-valmistetta saattaa erittyä äidinmaitoon. Siksi Lucentis-hoitoa ei suositella käytettäväksi imetyksen aikana. Kysy lääkäriltäsi tai apteekista neuvoa ennen Lucentis-hoitoa.
Ajaminen ja koneiden käyttö
Lucentis-hoidon jälkeen voi ilmaantua ohimenevää näön hämärtymistä. Jos tällaista ilmenee, älä aja äläkä käytä koneita ennen kuin oireet ovat hävinneet.
3. Miten valmistetta käytetään
Silmälääkäri antaa sinulle Lucentis-valmisteen kerta-injektiona silmään paikallispuudutuksessa. Tavanomainen injektioannos on 0,05 ml (mikä sisältää 0,5 mg vaikuttavaa ainetta). Esitäytetty ruisku sisältää enemmän lääkettä kuin 0,5 mg:n suositusannoksen. Esitäytetystä ruiskusta saatavaa kokonaismäärää ei tule käyttää kokonaan. Liuosylimäärä on poistettava ennen annostelua. Esitäytetyn ruiskun kokonaismäärän injisointi silmään voi johtaa yliannostukseen.
Kahden samaan silmään pistettävän annoksen välin on oltava vähintään 4 viikkoa. Injektiot antaa aina silmälääkäri.
Ennen injektion antoa lääkäri pesee silmäsi huolellisesti infektion ehkäisemiseksi. Lääkäri tulee myös käyttämään paikallispuudutetta injektion mahdollisesti aiheuttaman kivun ehkäisemiseksi tai vähentämiseksi.
Hoito aloitetaan yhdellä Lucentis-pistoksella kuukaudessa. Lääkäri seuraa silmäsi kuntoa. Hoitovasteesi perusteella hän päättää tarvitsetko lisäpistoksia ja milloin niitä tarvitset.
Yksityiskohtaiset ohjeet lääkkeen käyttöä varten annetaan tämän pakkausselosteen lopussa, kohdassa ”Lucentis-valmisteen valmistelu ja anto”.
Iäkkäät henkilöt (65-vuotiaat tai vanhemmat)
Lucentis-annostusta ei tarvitse muuttaa 65-vuotiaiden tai sitä vanhempien potilaiden hoidossa.
Ennen Lucentis-hoidon lopettamista
Jos harkitset Lucentis-hoidon lopettamista, keskustele asiasta lääkärin kanssa seuraavalla käyntikerralla. Lääkäri neuvoo Sinua ja päättää siitä, kuinka kauan Lucentis-hoitoa on syytä jatkaa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Lucentis-valmisteen antoon liittyvät haittavaikutukset johtuvat joko itse lääkkeestä tai sen antoon liittyvästä pistostoimenpiteestä. Suurin osa haittavaikutuksista kohdistuvat silmään.
Kaikista vakavimmat haittavaikutukset on kuvattu alla:
Yleiset haittavaikutukset (voivat ilmetä jopa 1 lääkkeen käyttäjällä 10:stä): silmän takaosassa olevan kalvon irtoaminen tai repeytyminen (verkkokalvon irtoaminen tai repeytyminen), mikä johtaa valosalamien ja pienten hiukkasten ilmaantumiseen näkökenttään ja sitä kautta tilapäiseen näön menetykseen; tai linssin samentuminen (kaihi).
Melko harvinaiset haittavaikutukset (voivat ilmetä jopa 1 lääkkeen käyttäjällä 100:sta): sokeus; silmämunan tulehdus (endoftalmiitti), joka on silmän sisäosien tulehdus.
Oireet, joita saatat kokea ovat silmäkipu tai lisääntynyt epämukavuuden tunne silmässäsi, paheneva silmän punoitus, näön hämärtyminen tai heikkeneminen, lisääntyvä pienten hiukkasten määrä näkökentässäsi tai lisääntynyt silmän valoherkkyys. Kerro välittömästi lääkärille, jos sinulla ilmenee jokin näistä haittavaikutuksista.
Kaikista yleisimmin raportoidut haittavaikutukset on kuvattu alla:
Hyvin yleiset haittavaikutukset (voivat ilmetä useammalla kuin 1:llä lääkkeen käyttäjällä 10:stä)
Näköön liittyvät haittavaikutukset: silmätulehdus, verenvuoto silmän takaosassa (verkkokalvon verenvuoto), näköhäiriöt, silmäkipu, pienet hiukkaset tai pisteet näkökentässä (lasiaissamentumat), verestävä silmä, silmän ärsytys, roskan- tai hiekantunne silmässä, lisääntynyt kyyneleritys, silmäluomien tulehdus, silmien kuivuminen, silmän punoitus tai kutina ja silmänpaineen kohoaminen.
Haittavaikutukset, jotka eivät liity näkökykyyn: kurkkukipu, nenän tukkoisuus, vuotava nenä, päänsärky ja nivelkipu.
Muut Lucentis-hoidon jälkeen mahdollisesti esiintyvät haittavaikutukset on kuvattu alla:
Yleiset haittavaikutukset
Näkökykyyn liittyvät haittavaikutukset: heikentynyt näöntarkkuus, silmän osan (suonikalvoston, sarveiskalvon) turpoaminen, sarveiskalvon (silmän etuosan) tulehdus, pienet jäljet silmän pinnalla, näön hämärtyminen, pistoskohdan verenvuoto, silmän sisäinen verenvuoto, silmien rähmiminen ja siihen liittyvä kutina, silmien punoitus ja turvotus (sidekalvotulehdus), valonarkuus, epämukava tunne silmässä, silmäluomen turpoaminen, silmäluomikipu.
Haittavaikutukset, jotka eivät liity näkökykyyn: virtsatieinfektio, alhainen veren punasolujen määrä (jonka oireina voi ilmetä väsymystä, hengästyneisyyttä, huimausta, kalpeaa ihoa), ahdistuneisuus, yskä, pahoinvointi, allergiset reaktiot kuten ihottuma, nokkosihottuma, kutina ja ihon punoitus.
Melko harvinaiset haittavaikutukset
Näkökykyyn liittyvät haittavaikutukset: tulehdus ja verenvuoto silmän etuosassa, märkäpesäke silmän pinnassa, muutokset silmän pinnan keskiosassa, injektiokohdan kipu tai ärsytys, poikkeavat tuntemukset silmässä, silmäluomen ärsytys.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan kansallisen ilmoitusjärjestelmän kautta. Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä pakkauksessa ja esitäytetyn ruiskun etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä jääkaapissa (2°C − 8°C). Ei saa jäätyä.
- Avaamaton repäisypakkaus voi olla huoneenlämmössä (25°C) enintään 24 tunnin ajan ennen käyttöä. Pidä esitäytetty ruisku avaamattomassa repäisypakkauksessaan ja pahvikotelossa. Herkkä valolle.
- Älä käytä, jos pakkaus on vahingoittunut.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Lucentis sisältää
- Vaikuttava aine on ranibitsumabi. Yksi ml sisältää 10 mg ranibitsumabia. Yksi esitäytetty ruisku sisältää 0,165 ml liuosta, mikä vastaa 1,65 mg ranibitsumabia. Tästä saadaan tarvittava määrä 0,05 ml eli 0,5 mg ranibitsumabia sisältävän kerta-annoksen annosteluun.
- Muut aineet ovat α,α-trehaloosidihydraatti; histidiinihydrokloridi, monohydraatti; histidiini; polysorbaatti 20; injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko
Lucentis-injektioneste on pakattu esitäytettyyn ruiskuun. Esitäytetty ruisku sisältää 0,165 ml steriiliä, kirkasta, väritöntä tai vaalean ruskeankeltaista vesiliuosta. Esitäytetty ruisku sisältää enemmän lääkettä kuin 0,5 mg:n suositusannoksen. Esitäytetystä ruiskusta saatavaa kokonaismäärää ei tule käyttää kokonaan. Liuosylimäärä on poistettava ennen annostelua. Esitäytetyn ruiskun kokonaismäärän injisointi silmään voi johtaa yliannostukseen.
Pakkauksessa on yksi esitäytetty ruisku suljetussa repäisypakkauksessa. Esitäytetty ruisku on tarkoitettu vain kertakäyttöön.
Myyntiluvan haltija
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlanti
Valmistaja
Novartis Pharma GmbH
Roonstrasse 25
90429 Nürnberg
Saksa
Alcon-Couvreur N.V.
Rijksweg 14
2870 Puurs
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Tämä pakkausseloste on tarkistettu viimeksi 6.10.2023
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu .
Ohjeet terveydenhuollon ammattilaiselle
Ks. lisäksi kohta Miten valmistetta käytetään. ”Miten Lucentis-valmistetta annetaan”.
Lucentis-valmisteen valmistelu ja anto
Kertakäyttöinen esitäytetty ruisku. Vain silmän lasiaiseen.
Lucentis-valmisteen antavalla silmälääkärillä on oltava kokemusta lasiaiseen annettavista injektioista.
Ikään liittyvän kostean verkkokalvon makulan rappeuman, silmän suonikalvon uudissuonittumisen (CNV), proliferatiivisen diabeettisen retinopatian (PDR) sekä diabeettisen makulaturvotuksen tai verkkokalvon laskimotukoksesta (RVO) johtuvan makulaturvotuksen aiheuttaman näkökyvyn heikkenemisen hoitoon suositeltu Lucentis-annos on 0,5 mg silmän lasiaiseen annettavana kertainjektiona. Tämä vastaa injektiotilavuutta 0,05 ml. Kahden samaan silmään annettavan pistoksen antovälin tulee olla vähintään neljä viikkoa.
Hoito aloitetaan antamalla yksi pistos kerran kuukaudessa kunnes maksimaalinen näöntarkkuus on saavutettu ja/tai silmässä ei ole havaittavissa tautiaktiivisuuden merkkejä, eli näöntarkkuudessa ei todeta muutoksia eikä potilaalla havaita muutoksia muissa sairauden merkeissä tai oireissa jatkuvan hoidon aikana. Potilaille, joilla on ikään liittyvä kostea verkkokalvon makulan rappeuma, diabeettinen makulaturvotus, proliferatiivinen diabeettinen retinopatia tai verkkokalvon laskimotukos, voi aluksi olla tarpeen antaa peräkkäisiä kuukausittaisia injektioita kolme tai useampia.
Tämän jälkeen lääkäri määrittää sopivat seuranta- ja hoitovälit sairauden aktiivisuuden mukaan, mikä arvioidaan näöntarkkuuden ja/tai anatomisten parametrien perusteella.
Jos visuaaliset ja anatomiset parametrit lääkärin arvion mukaan osoittavat, että potilas ei hyödy hoidon jatkamisesta, Lucentis-hoito tulee lopettaa.
Sairauden aktiivisuuden seurantaan voivat kuulua kliininen tutkiminen, toiminnalliset kokeet tai kuvaustekniikat (esim. valokerroskuvaus tai fluoreseiiniangiografia).
Kun maksimaalinen näöntarkkuus on saavutettu ja/tai tautiaktiivisuuden merkkejä tai oireita ei ole havaittavissa, voidaan pistosten antoväliä asteittain pidentää, jos potilaan hoito noudattaa annosteluohjelmaa, jossa hoitovälejä voidaan pidentää (TE, treat-and extend). Hoitovälien pidentämistä voidaan jatkaa, kunnes merkkejä tautiaktiivisuudesta tai näkökyvyn heikkenemistä jälleen ilmenee. Ikään liittyvän kostean verkkokalvon makulan rappeuman (AMD) hoidossa ei hoitoväliä saa pidentää kerralla kahta viikkoa enempää. Diabeettisen makulaturvotuksen (DME) hoidossa hoitoväliä saa pidentää enintään kuukauden verran kerrallaan. Proliferatiivisen diabeettisen retinopatian ja verkkokalvon laskimotukoksen hoidossa hoitoväliä voidaan myös asteittain pidentää, mutta hoitovälien pituuden määrittämiseksi ei ole saatavilla riittäviä tietoja. Jos tauti jälleen muuttuu aktiiviseksi, on hoitovälejä lyhennettävä sen mukaisesti.
Silmän suonikalvon uudissuonittumisen (CNV) aiheuttaman näkökyvyn heikkenemisen hoito on määriteltävä yksilöllisesti, taudin aktiivisuusasteen perusteella. Joillekin potilaille yksi pistos ensimmäisten 12 kuukauden aikana voi riittää, kun toiset puolestaan saattavat tarvita tiheämmin toistuvaa hoitoa, mukaan lukien kerran kuukaudessa annettavat pistokset. Patologisesta likitaittoisuudesta (PM) johtuvan silmän suonikalvon uudissuonittumisen (CNV) aiheuttaman näkökyvyn heikkenemisen hoidossa moni potilas tarvitsee vain yhden tai kaksi pistosta ensimmäisen hoitovuotensa aikana.
Lucentis ja laserkoagulaatio diabeettisen makulaturvotuksen sekä verkkokalvon laskimohaaratukoksen (BRVO) aiheuttaman makulaturvotuksen hoidossa
Lucentis-valmisteen samanaikaisesta käytöstä laserkoagulaation kanssa on jonkin verran kokemusta. Jos nämä hoidot annetaan samana päivänä, on Lucentis-hoito annettava aikaisintaan 30 minuuttia laserkoagulaation jälkeen. Lucentis-lääkitystä voidaan antaa potilaille, jotka jo aiemmin ovat saaneet laserkoagulaatiohoitoa.
Lucentis-valmisteen ja verteporfiinilla toteutetun fotodynaamisen hoidon käyttö patologisesta likitaittoisuudesta (PM) johtuvan suonikalvon uudissuonittumisen (CNV) hoitoon
Kokemusta Lucentisin ja verteporfiinin samanaikaisesta käytöstä ei ole.
Lucentis-valmiste on tarkistettava silmämääräisesti ennen käyttöä mahdollisten hiukkasten tai värimuutosten havaitsemiseksi.
Injektio on annettava aseptisissa olosuhteissa, mikä tarkoittaa kirurgista käsien desinfiointia, steriilien käsineiden, steriilien suojavaatteiden ja steriilin luomilevittimen (tai vastaavan) käyttöä ja tarvittaessa mahdollisuutta steriiliin parasenteesiin. Potilaan aiemmat yliherkkyysreaktiot on selvitettävä tarkoin ennen intravitreaalista toimenpidettä. Ennen injektiota silmää ympäröivä iho, silmäluomi ja silmän pinta desinfioidaan laajakirjoisella paikallisella mikrobisidilla sekä annetaan riittävä puudutus paikallisen hoitokäytännön mukaisesti.
Esitäytetty ruisku on tarkoitettu vain kertakäyttöön. Esitäytetty ruisku on steriili. Älä käytä valmistetta, jos pakkaus on vaurioitunut. Esitäytetyn ruiskun steriiliyttä ei voida taata, jos repäisypakkaus ei ole ehjä. Älä käytä esitäytettyä ruiskua, jos liuos on värjäytynyt, samea tai sisältää hiukkasia.
Esitäytetty ruisku sisältää enemmän lääkettä kuin 0,5 mg:n suositusannoksen. Esitäytetystä ruiskusta saatavaa kokonaismäärää (0,1 ml) ei tule käyttää kokonaan. Liuosylimäärä on poistettava ennen annostelua. Esitäytetyn ruiskun kokonaismäärän injisointi silmään voi johtaa yliannostukseen. Poista ilmakuplat ja ylimääräinen lääkevalmiste painamalla mäntää hitaasti kunnes männän kuperan kärjen reuna on ruiskussa olevan mustan annosviivan kohdalla (vastaa 0,05 ml eli 0,5 mg ranibitsumabia).
Lasiaiseen annettavaan injektioon tulee käyttää steriiliä, 30G x ½″-kokoista injektioneulaa.
Noudata käyttöohjeita valmistaessasi Lucentis-valmistetta annettavaksi silmän lasiaiseen:
|
Johdanto
|
Lue kaikki ohjeet huolellisesti ennen esitäytetyn ruiskun käyttöä.
Esitäytetty ruisku on tarkoitettu vain kertakäyttöön. Esitäytetty ruisku on steriili. Älä käytä valmistetta, jos repäisypakkaus on vaurioitunut. Repäisypakkauksen avaaminen ja kaikki sen jälkeen tehtävät toimenpiteet on suoritettava aseptisissa olosuhteissa.
Huom! Annos on asetettava 0,05 millilitraan.
|
|
Esitäytetyn ruiskun kuvaus
|
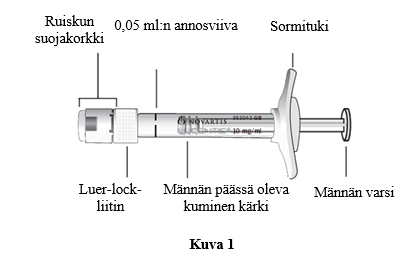
|
|
Esivalmistelut
|
1. Varmista, että pakkaus sisältää:
- steriilin esitäytetyn ruiskun ehjässä repäisypakkauksessa.
2. Revi kansi pois repäisypakkauksen päältä ja poista ruisku pakkauksestaan aseptista tekniikkaa noudattaen.
|
|
Tarkista ruisku
|
3. Tarkista, että:
- ruiskun suojakorkkia ei ole irrotettu Luer-lock-liittimestä.
- ruisku ei ole vaurioitunut
- liuos on kirkas, väritön tai vaalea ruskeankeltainen, eikä sisällä hiukkasia.
4. Jos jokin edellä mainituista kohdista ei täyty, kyseinen esitäytetty ruisku on hävitettävä ja annostelu suoritettava toisesta ruiskusta.
|
|
|
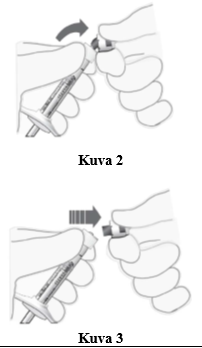
Ruiskun suojakorkin poistaminen
|
5. Napsauta (älä käännä tai kierrä) ruiskun suojakorkki irti (ks. kuva 2).
6. Heitä ruiskun suojakorkki roskiin (ks. kuva 3).
|
|
|
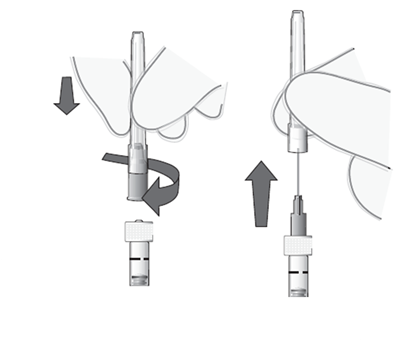
Kiinnitä neula
|
7. Kiinnitä steriili 30G x ½″-kokoinen injektioneula tukevasti ruiskuun kiertämällä se tiiviisti Luer-lock-liittimeen (ks. kuva 4).
8. Poista varovasti neulan suojus pystysuoraan vetämällä (ks. kuva 5).
Huom! Älä pyyhi neulaa missään vaiheessa.
|
Kuva 4 Kuva 5
|
|
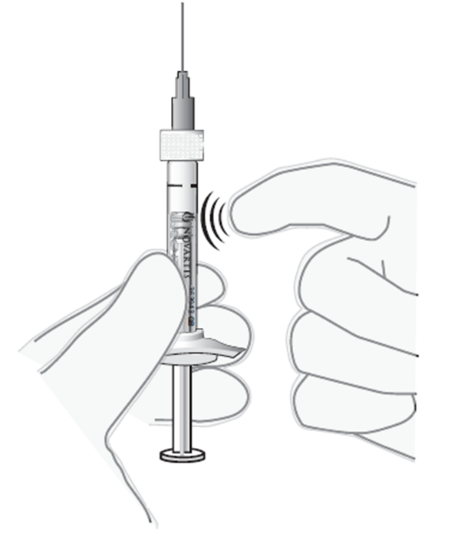
Poista ilmakuplat
|
9. Pidä ruisku pystyasennossa.
10. Jos liuoksessa on ilmakuplia, naputtele varovasti ruiskun kylkeä kunnes kuplat nousevat liuoksen pintaan (ks. kuva 6).
|
Kuva 6
|
|
Säädä annos
|
11. Nosta ruisku silmiesi korkeudelle ja paina varovasti mäntää, kunnes männän kumisen kärjen reuna on ruiskun mustan annosviivan kohdalla (ks. kuva 7). Näin ruiskussa oleva ilma ja ylimääräinen liuos poistuvat ja annos asettuu määrään 0,05 ml.
Huom! Männän varsi ei ole kiinni männän kumisessa päässä. Tämä estää ilman vetämisen ruiskuun.
|
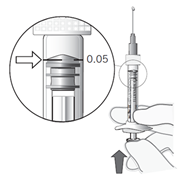
Kuva 7
|
|
Injektion anto
|
Injektiotoimenpide on annettava aseptisissa olosuhteissa.
12. Injektioneula pistetään 3,5 - 4,0 mm limbuksesta posteriorisesti lasiaiseen, vältetään horisontaalista meridiaania ja tähdätään silmämunan keskikohtaan.
13. Liuos injisoidaan hitaasti, kunnes männän kuminen kärki saavuttaa ruiskun pohjan ja silmään on siirtynyt 0,05 ml:n annos.
14. Kovakalvon pistoskohtaa vaihdetaan seuraavissa injektioissa.
15. Kun injektio on annettu, neulansuojusta ei tule asettaa takaisin eikä neulaa irrottaa ruiskusta. Ruisku ja siinä oleva neula hävitetään heittämällä ne viiltävälle jätteelle tarkoitettuun astiaan tai paikallisten vaatimusten mukaisesti.
|