Confidex® 500 IU
Confidex® 1000 IU
Injektiokuiva-aine ja liuotin, liuosta varten.
ihmisen protrombiinikompleksi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Confidex on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Confidex-valmistetta
- Miten Confidex-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Confidex-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Mitä Confidex on?
Confidex koostuu kuiva-aineesta ja liuottimesta. Valmiste on valkoinen tai vaaleanvärinen jauhe tai mureneva kiinteä aine. Näistä saadaan liuos, joka annetaan pistoksena laskimoon.
Confidex on valmistettu ihmisen plasmasta (veren nestemäinen osa) ja se sisältää ihmisen hyytymistekijöitä II, VII, IX ja X. Näitä hyytymistekijöitä sisältäviä konsentraatteja kutsutaan protrombiinikompleksivalmisteiksi. Hyytymistekijät II, VII, IX ja X ovat riippuvaisia K-vitamiinista ja ne ovat tärkeitä veren hyytymisen kannalta. Jonkin näiden hyytymistekijöiden puutos tarkoittaa, ettei veri hyydy niin nopeasti kuin sen pitäisi ja että verenvuototaipumus on tällöin suurempi. Hyytymistekijöiden II, VII, IX ja X korvaaminen Confidex-valmisteella korjaa hyytymismekanismia.
Mihin Confidex-valmistetta käytetään?
Confidex-valmistetta käytetään K-vitamiiniriippuvaisten hyytymistekijöiden II, VII, IX ja X hankinnaisesta tai synnynnäisestä puutoksesta aiheutuvien verenvuotojen estoon (leikkauksen aikana) tai hoitoon, kun puhdistettua kyseistä yksittäistä hyytymistekijää sisältävää valmistetta ei ole saatavana.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Seuraavissa kohdissa on tietoa, joka lääkärin on huomioitava ennen kuin saat Confidex-hoitoa.
ÄLÄ käytä Confidex-valmistetta:
- jos olet allerginen vaikuttaville aineille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Kerro lääkärille, jos olet allerginen jollekin lääkkeelle tai ruoka-aineelle.
- jos sinulla on tavanomaista suurempi verihyytymien muodostumisen riski (DIC-oireyhtymä eli yleistynyt suonensisäinen hyytyminen)
- jos olet allerginen hepariinille, joka pienentää verihiutalemäärää (hepariinin aiheuttama tyypin II trombosytopenia).
Kerro lääkärille tai apteekkihenkilökunnalle, jos sinulla on tällainen sairaus.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen Confidex-valmisteen käyttöä, jos jokin seuraavista koskee sinua.
- Hankinnainen K-vitamiinista riippuvaisten hyytymistekijöiden puutos. Se saattaa johtua K-vitamiinin vaikutuksia estävästä lääkehoidosta. Confidex-valmistetta voi käyttää vain, kun protrombiinikompleksipitoisuus on korjattava nopeasti esim. voimakkaiden verenvuotojen tai hätäleikkausten yhteydessä.
- K-vitamiinista riippuvaisen hyytymistekijän synnynnäinen puutos. Tällaisessa tapauksessa sinun on käytettävä kyseistä yksittäistä hyytymistekijää sisältävää valmistetta, jos sellaista on saatavana.
- Allergiset tai anafylaksian kaltaiset reaktiot (vakava allerginen reaktio, joka aiheuttaa vaikeita hengitysvaikeuksia tai huimausta). Confidex-valmisteen antaminen on lopetettava heti (esim. pistoksen antaminen on keskeytettävä). Confidex valmisteen antaminen on lopetettava heti (esim. pistoksen antaminen on keskeytettävä).
- Verisuoneen muodostuvien hyytymien (tromboosin) suurentunut riski, etenkin:
- jos sinulla on ollut sydänkohtaus (aiemmin sairastettu sepelvaltimotauti tai sydäninfarkti)
- jos sairastat maksasairautta
- jos olet äskettäin ollut leikkauksessa (peri- ja postoperatiiviset potilaat)
- jos potilas on vastasyntynyt lapsi
- jos verihyytymien muodostuminen on sinulla normaalia todennäköisempää (potilaat, joilla on verisuonten tukkeumien tai DIC-oireyhtymän riski tai samanaikainen vasta-aineiden puutos).
- Suurentunut hyytymien muodostumisen riski verihiutaleiden tai veren hyytymistekijöiden lisääntyneen kulutuksen vuoksi. Confidex-hoito voidaan aloittaa vasta, kun taustalla oleva syy on hoidettu.
- Verihiutaleiden muodostumisen vähentyminen hepariinin vuoksi (hepariinin aiheuttama tyypin II trombosytopenia). Verihyytymiä liuottava proteiini, hepariini, on Confidex- valmisteen aineosa. Vaikeaan verihiutaleiden määrän vähenemiseen saattaa liittyä
- verihyytymien muodostumista laskimoon tai jalkaan
- verihyytymien muodostumisen lisääntymistä
- toisinaan ihottumaa pistoksen antopaikassa
- neulanpään kokoisia verenvuotoja ja
- tervamaisia ulosteita.
Hepariinin vaikutus saattaa tällöin heikentyä (hepariinitoleranssi). Jos tällaisia oireita ilmaantuu, lopeta valmisteen käyttö heti ja ota yhteyttä lääkäriin. Et saa enää myöhemmin käyttää hepariinia sisältäviä valmisteita.
- Erityistä munuaistulehduksen muotoa on ilmoitettu, kun hoitoa annettiin potilaille, joilla on hyytymistekijä IX:n vasta-aineita. Näillä potilailla tiedettiin esiintyneen aiemmin myös allergisia reaktioita.
Lääkäri punnitsee tarkoin Confidex-hoidon hyödyt näiden lisäsairauksien riskiin nähden.
Virusturvallisuus
Kun ihmisen verestä tai plasmasta valmistetaan lääkkeitä, infektioiden siirtymistä potilaisiin estetään tietyin toimenpitein. Tällaisia toimenpiteitä ovat:
- veren ja plasman luovuttajien tarkka valinta sen varmistamiseksi, että infektioita mahdollisesti kantavat henkilöt voidaan sulkea pois
- kaikesta luovutetusta verestä ja plasmasta sekä plasmapooleista tutkitaan viruksiin/infektioihin viittaavat merkit ja
- valmistuksenaikaiset tehokkaat toimenpiteet virusten inaktivoimiseksi/poistamiseksi verestä ja plasmapooleista.
Tällaisista toimenpiteistä huolimatta taudinaiheuttajien siirtymisen mahdollisuutta ei voida täysin sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita. Tämä koskee myös tuntemattomia tai vasta kehittymässä olevia viruksia tai muuntyyppisiä infektioita.
Käytössä olevien toimenpiteiden katsotaan tehoavan hyvin vaipallisiin viruksiin, kuten ihmisen immuunikatovirukseen (HI-virus), hepatiitti B -virukseen, hepatiitti C -virukseen sekä vaipattomaan hepatiitti A -virukseen ja parvovirus B19:ään.
Lääkäri saattaa suositella rokotuksen ottamista hepatiitti A:ta ja B:tä vastaan, jos saat säännöllisesti/toistuvasti ihmisen plasmasta valmistettuja protrombiinikompleksivalmisteita.
Aina kun saat Confidex-pistoksen, lääkärin tulisi kirjata muistiin valmisteen nimi ja eränumero, jotta annettu erä voidaan tarvittaessa selvittää.
Muut lääkevalmisteet ja Confidex
- Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
- Confidex saattaa estää K-vitamiinin vaikutuksia estävän hoidon tehoa. Yhteisvaikutuksia muiden lääkevalmisteiden kanssa ei tunneta.
- Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden, kanssa lukuun ottamatta niitä, jotka mainitaan kohdassa Pakkauksen sisältö ja muuta tietoa.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
- Confidex-valmistetta ei pitäisi käyttää raskauden ja imetyksen aikana, mikäli käyttö ei ole selvästi välttämätöntä.
- Hedelmällisyyttä koskevia tietoja ei ole saatavissa.
Ajaminen ja koneiden käyttö
Tutkimuksia valmisteen vaikutuksista ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Confidex sisältää natriumia
Confidex sisältää natriumia enintään 343 mg (noin 15 mmol) per 100 ml. Potilaiden, joilla on ruokavalion natriumrajoitus, tulee ottaa tämä huomioon.
3. Miten valmistetta käytetään
Hoito on aloitettava ja toteutettava tällaisen sairauden hoitoon perehtyneen lääkärin valvonnassa.
Annostus
Tarvitsemasi hyytymistekijän II, VII, IX ja X määrä ja hoidon kesto riippuvat useista tekijöistä, kuten painosta, sairautesi vaikeusasteesta ja luonteesta, verenvuotokohdasta ja vuodon voimakkuudesta tai verenvuotojen eston tarpeesta leikkauksen aikana tai tutkimustoimenpiteiden yhteydessä (ks. kohta Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille).
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Yliannostus
Lääkärin on seurattava veresi hyytymistilannetta säännöllisesti hoidon aikana. Suuriin protrombiinikompleksikonsentraattiannoksiin on liittynyt sydänkohtauksia, DIC-oireyhtymää ja lisääntynyttä verihyytymien muodostumista verisuoniin, jos potilaalla on ollut tällaisten lisäsairauksien riski.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on havaittu yleisenä (saattaa esiintyä enintään 1 henkilöllä 10:stä):
- verihyytymien muodostuminen verisuoniin on mahdollista (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä)
- päänsärky
- ruumiinlämmön kohoaminen.
Seuraavia haittavaikutuksia on esiintynyt melko harvoin (saattaa esiintyä enintään 1 henkilöllä 100:sta):
- yliherkkyys- tai allergiset reaktiot (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä)
Seuraavia haittavaikutuksia on raportoitu (saattaa esiintyä tuntemattomalla määrällä käyttäjiä):
- liiallinen hyytyminen aiheuttaen voimakasta verenvuotoa
- vakava allerginen reaktio (anafylaktinen reaktio), sokki mukaan lukien (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä)
- kiertävien vasta-aineiden muodostumista yhdelle tai useammalle hyytymistekijälle.
Lapset ja nuoret
Confidex-valmisteen käytöstä lapsille ja nuorille ei ole tutkimustietoa.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
5. Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä etiketissä ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen.
- Säilytä alle 25 °C.
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
- Confidex ei sisällä säilytysainetta, joten valmiiksi sekoitettu injektioneste on käytettävä mieluiten heti.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Confidex sisältää
500 IU Confidex-injektiopullo sisältää 400–620 IU:ta ihmisen hyytymistekijä IX:ää.
1000 IU Confidex injektiopullo sisältää 800 – 1240 IU ihmisen hyytymistekijä IX:ää.
Vaikuttava aine on:
Ihmisen hyytymistekijöitä II, VII, IX ja X sekä proteiineja C ja S sisältävä konsentraatti.
Muut aineet ovat:
Ihmisen antitrombiini III, hepariini, ihmisen albumiini, natriumkloridi, natriumsitraatti, vetykloridihappo tai natriumhydroksidi (pieniä määriä pH:n säätämiseen).
Liuotin: Injektionesteisiin käytettävä vesi
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Confidex on valkoinen tai vaaleanvärinen kuiva-aine, jonka lisäksi pakkaus sisältää injektionesteisiin käytettävää vettä liuottimena käytettäväksi. Kuiva-aine liuotetaan 20 ml:aan (500 IU) tai 40 ml:aan (1000 IU) injektionesteisiin käytettävää vettä.
Käyttövalmiiksi sekoitetun liuoksen on oltava kirkasta tai hieman opaalinhohtoista eli se saattaa välkehtiä hieman valoa vasten katsottuna, mutta siinä ei saa olla silmämääräisesti havaittavia hiukkasia.
Pakkaus
Yksi 500 IU:n pakkaus sisältää:
- yhden kuiva-ainetta sisältävän injektiopullon
- yhden 20 ml injektionesteisiin käytettävää vettä sisältävän injektiopullon
- yhden suodattimella varustetun siirtolaitteen 20/20
Yksi 1000 IU:n pakkaus sisältää:
- yhden kuiva-ainetta sisältävän injektiopullon
- yhden 40 ml injektionesteisiin käytettävää vettä sisältävän injektiopullon
- yhden suodattimella varustetun siirtolaitteen 20/20
Myyntiluvan haltija ja valmistaja
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
CSL Behring AB
Box 712
182 17 Danderyd
Ruotsi
Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
| Itävalta |
Beriplex P/N 500 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung |
| Belgia |
Confidex 500 I.E., poeder en oplosmiddel voor oplossing voor injectie |
| Bulgaria |
Beriplex P/N 500, 500 IU, Powder and solvent for solution for injection |
| Kroatia |
Beriplex P/N 500 IU prašak i otapalo za otopinu za injekciju |
| Tshekki |
Beriplex 500 IU |
| Tanska |
Confidex |
| Suomi |
Confidex 500 IU injektiokuiva-aine ja liuotin, liuosta varten |
| Ranska |
Confidex 500 UI, poudre et solvant pour solution injectable |
| Saksa |
Beriplex P/N 500 |
| Kreikka |
Beriplex P/N, Κόνις και διαλύτης για ενέσιμο διάλυμα 500 IU/vial |
| Unkari |
Beriplex P/N 500 por és oldószer oldatos injekcióhoz |
| Irlanti |
Beriplex P/N 500 IU, powder and solvent for solution for injection |
| Italia |
Confidex 500 |
| Luxemburg |
Confidex 500 UI poudre et solvant pour solution injectable |
| Malta |
Beriplex P/N 500, powder and solvent for solution for injection |
| Alankomaat |
Beriplex P/N 500 IE, poeder en oplosmiddel voor oplossing voor injectie |
| Norja |
Confidex 500 IU pulver og væske til injeksjonsvæske, oppløsning |
| Portugali |
Beriplex 500 UI pó e solvente para solução injectável |
| Puola |
Beriplex P/N 500 |
| Romania |
Beriplex P/N 500 UI pulbere și solvent pentru soluție injectabilă |
| Espanja |
Beriplex 500 UI polvo y disolvente para solución inyectable |
| Ruotsi |
Confidex 500 IE, pulver och vätska till injektionsvätska, lösning |
| Slovakia |
Beriplex 500 IU |
| Slovenia |
Beriplex P/N 500 i.e. prašek in vehikel za raztopino za injiciranje |
| Iso-Britannia |
Beriplex P/N 500 IU, powder and solvent for solution for injection |
Tämä pakkausseloste on tarkistettu viimeksi: 13.07.2017
-------------------------------------------------------------------------
Ohjeet terveydenhuollon ammattilaiselle
Vaikuttavat aineet ja niiden määrät
Valmiste sisältää nimellisesti seuraavassa taulukossa esitetyt määrät (IU) ihmisen hyytymistekijöitä:
| Aineosan nimi |
Sisältö käyttövalmiiksi sekoittamisen jälkeen (IU/ml) |
Sisältö
Confidex 500 IU
-injektiopullossa
(IU) |
Sisältö
Confidex 1000 IU
-injektiopullossa
(IU) |
| Vaikuttavat aineet |
|
|
|
| Ihmisen hyytymistekijä II |
20 – 48 |
400 – 960 |
800 - 1920 |
| Ihmisen hyytymistekijä VII |
10 – 25 |
200 – 500 |
400 - 1000 |
| Ihmisen hyytymistekijä IX |
20 – 31 |
400 – 620 |
800 - 1240 |
| Ihmisen hyytymistekijä X |
22 – 60 |
440 – 1200 |
880 - 2400 |
| Muut vaikuttavat aineet |
|
|
|
| Proteiini C |
15 – 45 |
300 – 900 |
600 - 1800 |
| Proteiini S |
12 – 38 |
240 – 760 |
480 - 1520 |
Käyttövalmiiksi sekoitetun liuoksen kokonaisproteiinisisältö on 6-14 mg/ml.
Hyytymistekijä IX:n spesifinen aktiivisuus on 2,5 IU/kokonaisproteiinimäärä (mg).
Kaikkien hyytymistekijöiden sekä proteiinin C ja proteiinin S (antigeeni) aktiivisuus on tutkittu voimassaolevien kansainvälisten WHO-standardien mukaisesti.
Annostus ja antotapa
Annostus
Seuraavassa on esitetty vain yleiset annostusohjeet.
Annettava määrä ja antotiheys on laskettava jokaiselle potilaalle yksilöllisesti. Annosväli on määritettävä protrombiinikompleksin kunkin hyytymistekijän verenkierrossa havaittavan eripituisen puoliintumisajan mukaan. Yksilölliset annostustarpeet voidaan todeta vain yksilöllisten plasman hyytymistekijäpitoisuuksien säännöllisellä määrittämisellä tai protrombiinikompleksipitoisuuden määrittämisellä yleistestien (INR, tromboplastiiniaika) avulla ja seuraamalla jatkuvasti potilaan kliinistä tilaa.
Suurten kirurgisten toimenpiteiden yhteydessä korvaushoidon tarkka seuranta hyytymistekijäpitoisuusmääritysten avulla on välttämätöntä (kunkin yksittäisen hyytymistekijän pitoisuusmääritykset ja/tai protrombiinikompleksipitoisuuden yleistestit).
- Verenvuotojen hoito ja leikkauksiin liittyvien verenvuotojen estohoito K-vitamiiniantagonistihoidon aikana.
Annostus riippuu hoitoa edeltävästä INR-arvosta ja tavoitteeksi asetetusta INR-arvosta. Hoitoa edeltävä INR-arvo on mitattava mahdollisimman lähellä antoajankohtaa, jotta asianmukainen Confidex-annos saadaan laskettua. Seuraavassa taulukossa esitetään hoidon alussa esiintyvien eri INR-arvojen normalisoimiseksi (esim. ≤ 1,3) tarvittava likimääräinen annos (käyttövalmiiksi sekoitettua valmistetta (ml)/painokiloa kohden (kg) sekä hyytymistekijää IX (IU)/painokiloa kohden (kg)).
| Hoitoa edeltävä INR-arvo |
2,0 – 3,9 |
4,0 – 6,0 |
> 6,0 |
| Likimääräinen annos (ml)/painokilo (kg) |
1 |
1,4 |
2 |
| Likimääräinen annos hyytymistekijää IX (IU) / painokiloa kohden (kg) |
25 |
35 |
50 |
Annos perustuu potilaan painoon enintään 100 kg:aan asti. Yli 100 kg painaville potilaille suurin kerta-annos (IU hyytymistekijää IX) on 2 500 IU, jos INR-arvo on 2,0–3,9, 3 500 IU, jos INR-arvo on 4,0–6,0, ja 5 000 IU, jos INR-arvo on > 6,0.
K-vitamiiniantagonistihoidosta aiheutuva hemostaasin heikkeneminen korjautuu yleensä noin 30 minuutin kuluttua pistoksesta. Samanaikaista K-vitamiinin antamista Confidex-valmistetta saaville potilaille on harkittava K-vitamiiniantagonistihoidon vaikutuksen nopeaan kumoamiseen, koska K-vitamiinin vaikutukset ilmaantuvat yleensä 4-6 tunnin kuluessa. Kliiniset tutkimustulokset eivät tue Confidex-hoidon toistamista potilaille, jotka tarvitsevat K-vitamiiniantagonistihoidon vaikutuksen nopeaa kumoamista, eikä sitä siksi suositella.
Nämä suositukset perustuvat pienellä potilasmäärällä toteutetuista kliinisistä lääketutkimuksista saatuihin tietoihin. Potilaan tilan paraneminen ja valmisteen vaikutuksen kesto voivat vaihdella, joten INR-arvojen seuranta on hoidon aikana siksi välttämätöntä.
- Verenvuodot ja leikkauksiin liittyvä verenvuotojen estohoito synnynnäisen K-vitamiinista riippuvaisen hyytymistekijän puutoksen yhteydessä, kun puhdistettua kyseistä yksittäistä hyytymistekijää sisältävää valmistetta ei ole saatavilla.
Tarvittavan protrombiinikompleksikonsentraattiannoksen laskeminen perustuu kliinisistä lääketutkimuksista saatuihin tietoihin:
- 1 IU:n hyytymistekijä IX:ää potilaan painokiloa kohden (kg) voidaan odottaa suurentavan plasman hyytymistekijä IX -aktiivisuutta 1,3 % (0,013 IU/ml) normaaliin verrattuna
- 1 IU hyytymistekijä VII:ää potilaan painokiloa kohden (kg) suurentaa plasman hyytymistekijä VII -aktiivisuutta 1,7 % (0,017 IU/ml) normaaliin verrattuna
- 1 IU hyytymistekijä II:a potilaan painokiloa kohden (kg) suurentaa plasman hyytymistekijä II -aktiivisuutta 1,9 % (0,019 IU/ml) normaaliin verrattuna
- 1 IU hyytymistekijä X:ä potilaan painokiloa kohden (kg) suurentaa plasman hyytymistekijä X -aktiivisuutta 1,9 % (0,019 IU/ml) normaaliin verrattuna.
Annettava hyytymistekijäannos ilmaistaan kansainvälisinä yksikköinä (International Units, IU), mikä perustuu kunkin hyytymistekijän voimassa olevaan WHO-standardiin. Yksittäisen hyytymistekijän vaikutus plasmassa ilmaistaan joko prosentteina (suhteessa normaaliin plasmaan) tai kansainvälisinä yksikköinä (kyseisen hyytymistekijän kansainvälisen standardin perusteella).
Yksi kansainvälinen yksikkö (International Unit, IU) hyytymistekijäaktiivisuutta vastaa kyseisen hyytymistekijän määrää millilitrassa normaalia ihmisen plasmaa.
Esimerkiksi, hyytymistekijä X:n tarvittavan annoksen laskeminen perustuu siihen löydökseen, että yksi kansainvälinen yksikkö (IU) hyytymistekijää X painokiloa (kg) kohden suurentaa plasman hyytymistekijä X -aktiivisuutta 0,019 IU/ml.
Tarvittava annos lasketaan seuraavalla laskukaavalla:
Tarvittava määrä yksikköinä = potilaan paino [kg] x haluttu hyytymistekijä X:n pitoisuuden suureneminen [IU/ml] x 53
jossa 53 (ml/kg) on arvioidun saannon käänteisluku.
Huomaa, että laskelma perustuu tuloksiin, jotka on saatu tutkimuksista K-vitamiiniantagonistihoitoa saavilla potilailla. Jos laskelma tehtäisiin terveiltä tutkimushenkilöiltä saatujen tulosten perusteella, arvio tarvittavasta annoksesta olisi pienempi.
Jos yksilöllinen saanto tiedetään, laskennassa on käytettävä tätä arvoa.
Valmistekohtaisia tietoja on saatavissa terveillä vapaaehtoisilla tutkimushenkilöillä (N=15) tehdyistä kliinisistä tutkimuksista, joissa tutkittiin K-vitamiiniantagonistihoidon vaikutuksen kumoamista akuutin vakavan verenvuodon yhteydessä tai perioperatiivisesti verenvuodon estohoidossa (N = 98, N = 43).
Käyttö lapsilla
Confidex-valmisteen turvallisuutta ja tehoa lasten ja nuorten hoidossa ei ole vielä varmistettu kontrolloiduissa kliinisissä tutkimuksissa.
Iäkkäät potilaat
Iäkkäiden (yli 65-vuotiaiden) potilaiden annostus ja antotapa ovat yleisten annossuositusten mukaiset.
Antotapa
Yleiset ohjeet
- Injektionesteen on oltava kirkasta tai hieman opaalinhohtoista. Kun käyttövalmiiksi sekoitettu valmiste on suodatettu/vedetty ruiskuun (ks. seuraavassa), valmiste on tarkistettava silmämääräisesti ennen antoa, ettei siinä ole havaittavissa hiukkasia eikä värimuutoksia.
- Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa.
- Valmisteen käyttövalmiiksi sekoittaminen ja vetäminen ruiskuun on tehtävä aseptisissa olosuhteissa.
Käyttövalmiiksi sekoittaminen
Lämmitä liuotin huoneenlämpöiseksi. Varmista, että kuiva-aineen ja liuottimen sisältävien injektiopullojen irti napsautettavat flip-off-sulkimet on poistettu ja tulpat on käsitelty antiseptisella liuoksella. Tulpan on sen jälkeen annettava kuivua ennen Mix2Vial-pakkauksen avaamista.
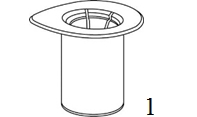 |
1. Avaa Mix2Vial-pakkaus vetämällä suojakansi pois. Älä ota Mix2Vial-laitetta pois pakkauksesta! |
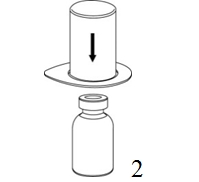 |
2. Aseta liuottimen sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial sekä pakkaus ja paina sinisen sovittimen piikki suoraan liuotinpullon tulpan läpi. |
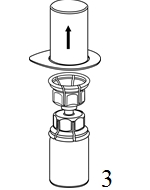 |
3. Poista pakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain pakkauksen etkä Mix2Vial-laitetta. |
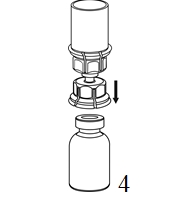 |
4. Aseta injektiopullo tasaiselle ja tukevalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial ylösalaisin, ja paina läpinäkyvän sovittimen piikki suoraan kuiva-aineinjektiopullon tulpan läpi. Liuotin siirtyy automaattisesti kuiva-aineen sisältävään injektiopulloon. |
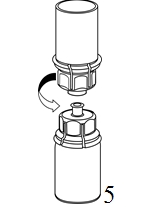 |
5. Ota toisella kädellä kiinni Mix2Vial-laitteen kuiva-aineen sisältävän injektiopullon puolelta ja toisella kädellä liuottimen sisältävän injektiopullon puolelta ja kierrä vastapäivään laite varovasti kahteen osaan.
Hävitä liuotinpullo ja siihen kiinnitetty sininen Mix2Vial-sovitin. |
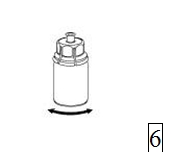 |
6. Pyörittele kuiva-aineinjektiopulloa ja siihen kiinnitettyä läpinäkyvää sovitinta, kunnes kuiva-aine on liuennut täysin. Ei saa ravistaa. |
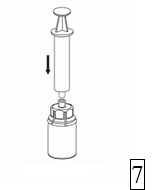 |
7. Vedä ilmaa tyhjään, steriiliin ruiskuun. Kun kuiva-aineen sisältävä injektiopullo on oikeinpäin, kiinnitä ruisku Mix2Vial-sovittimen Luer Lock-liittimeen kiertäen myötäpäivään. Ruiskuta ilma kuiva-aineen sisältävään injektiopulloon. |
Valmisteen vetäminen ruiskuun ja anto
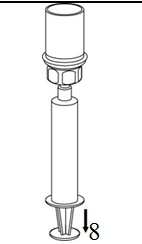 |
8. Kun ruiskun mäntä on alas painettuna, käännä laite ja injektiopullo ylösalaisin ja vedä liuos ruiskuun vetämällä mäntää hitaasti ulospäin. |
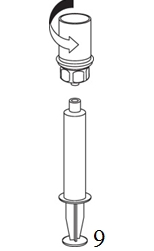 |
9. Kun liuos on nyt siirretty ruiskuun, ota tukeva ote ruiskun kammiosta (pitäen ruiskun mäntää samalla alaspäin) ja irrota Mix2Vial-sovitin kiertäen vastapäivään. |
Veren pääsyä valmisteella täytettyyn ruiskuun on varottava, koska tällöin on vaara, että veri hyytyy ruiskuun ja siten muodostunut fibriinihyytymä annetaan potilaalle.
Jos on tarpeen käyttää useampia Confidex-injektiopulloja, niiden sisältö voidaan yhdistää annettavaksi infuusiona infuusiolaitteistolla.
Confidex-liuosta ei saa laimentaa.
Käyttövalmiiksi sekoitettu liuos annetaan laskimoon (enintään 8 ml/min*).
Käyttämätön lääkevalmiste ja jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Varoitukset ja käyttöön liittyvät varotoimet
Confidex -valmisteen käytöstä vastasyntyneiden K-vitamiinin puutokseen liittyvän syntymänaikaisen verenvuodon yhteydessä ei ole tietoa.
Huomioitavaa verihiutalemäärän seuraamisessa:
Verihiutalemäärää on seurattava tarkoin.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muutyhteisvaikutukset
Kun suurina annoksina ihmisen protrombiinikompleksia saaville potilaille tehdään hepariinille herkkiä veren hyytymiskokeita, on huomioitava, että annettu valmiste sisältää hepariinia.
________________________________________________
* Confidexin kliinisissä tutkimuksissa infuusio ohjeistettiin antamaan alle 70 kg painaville potilaille enintään nopeudella 0,12 ml/kg/min (enintään 8 ml/min).