IDELVION 250 IU injektiokuiva-aine ja liuotin, liuosta varten
IDELVION 500 IU injektiokuiva-aine ja liuotin, liuosta varten
IDELVION 1000 IU injektiokuiva-aine ja liuotin, liuosta varten
IDELVION 2000 IU injektiokuiva-aine ja liuotin, liuosta varten
IDELVION 3500 IU injektiokuiva-aine ja liuotin, liuosta varten
albutrepenonakogi alfa (rekombinantti hyytymistekijä IX)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä IDELVION on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät IDELVION-valmistetta
3. Miten IDELVION-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. IDELVION-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Mitä IDELVION on?
IDELVION on hemofilialääke, joka korvaa elimistön oman verta hyydyttävän hyytymistekijä IX:n. IDELVION-valmisteen vaikuttava aine on albutrepenonakogi alfa (rekombinantti fuusioproteiini, joka koostuu ihmisen albumiiniin liitetystä ihmisen hyytymistekijästä IX [rIX-FP]).
Hyytymistekijä IX osallistuu veren hyytymiseen. B‑hemofiliapotilailta tämä hyytymistekijä puuttuu, ja siksi näiden potilaiden veri hyytyy tavallista hitaammin, mikä lisää verenvuototaipumusta. IDELVION toimii korvaamalla hyytymistekijä IX:n B‑hemofiliaa sairastavilla potilailla, jolloin veri voi hyytyä.
Mihin IDELVION-valmistetta käytetään?
IDELVION-valmistetta käytetään hyytymistekijä IX:n puutoksesta johtuvan verenvuodon ehkäisyyn ja pysäyttämiseen kaikenikäisille B‑hemofiliaa sairastaville potilaille (synnynnäinen hyytymistekijä IX:n puutos).
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä IDELVION-valmistetta
- jos olet allerginen vaikuttavalle aineelle (albutrepenonakogi alfalle) tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos olet allerginen hamsterin valkuaisaineille (proteiineille).
Varoitukset ja varotoimet
On erittäin suositeltavaa, että aina kun käytät IDELVION-valmistetta, kirjaat valmisteen nimen ja eränumeron ylös, jotta tieto käyttämistäsi valmisteista ja valmiste-eristä säilyy.
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät IDELVION-valmistetta.
- Allergiset (yliherkkyys-) reaktiot ovat mahdollisia. Valmiste sisältää hamsterin valkuaisaineiden (proteiinien) jäämiä (ks. myös ”Älä käytä IDELVION-valmistetta”). Jos allergisen reaktion oireita ilmaantuu, lopeta heti lääkkeen käyttö ja ota yhteyttä lääkäriin tai hoitoyksikköön, jossa tilaasi seurataan. Lääkäri kertoo sinulle yliherkkyysreaktioiden varhaiset merkit. Näitä ovat nokkosihottuma, yleistynyt ihottuma, puristuksen tunne rinnassa, hengityksen vinkuminen, matala verenpaine (hypotensio) ja anafylaksia (vakava allerginen reaktio, josta aiheutuu vaikea-asteisia hengitysvaikeuksia tai huimausta).
- Koska hyytymistekijä IX:n antoon liittyy allergisten reaktioiden riski, ensimmäinen IDELVION-annos on annettava lääkärin valvonnassa, jotta allergiset reaktiot voidaan hoitaa asianmukaisesti.
- Inhibiittoreiden (neutraloivien vasta-aineiden) muodostuminen on tunnettu komplikaatio, jota on ilmoitettu IDELVION-hoidon aikana. Inhibiittorit estävät hoitoa tehoamasta asianmukaisesti. Jos verenvuodot eivät pysy hallinnassa IDELVION-hoidon avulla, kerro siitä heti lääkärille. Tilaasi on seurattava säännöllisesti vasta-aineiden kehittymisen havaitsemiseksi.
- Jos sinulla on maksa- tai sydänsairaus tai jos sinulle on äskettäin tehty suuri leikkaus, kerro tästä lääkärille, koska veren hyytymisestä (koagulaatiosta) johtuvien komplikaatioiden riski on suurentunut.
- Jos tarvitset keskuslaskimokatetrin (CVAD IDELVION-injektiota varten), lääkärin on huomioitava riski komplikaatioihin, kuten paikallisiin infektioihin, bakteerien esiintymiseen veressä (bakteremiaan) ja veritulpan (tromboosin) muodostumiseen katetrin kohtaan.
Muut lääkevalmisteet ja IDELVION
- Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
- Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
- IDELVION-valmistetta on käytettävä raskauden ja imetyksen aikana vain, jos se on selkeästi tarpeellista.
Ajaminen ja koneiden käyttö
IDELVION-valmisteella ei ole vaikutusta ajokykyyn tai kykyyn käyttää koneita.
IDELVION sisältää natriumia
Tämä lääkevalmiste sisältää enintään 8,6 mg natriumia (ruokasuolan toinen aineosa) per injektiopullo. Tämä vastaa 0,4 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
3. Miten valmistetta käytetään
Veren hyytymishäiriöihin perehtynyt lääkäri aloittaa hoitosi ja seuraa sitä. Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Lääkäri laskee tarvitsemasi IDELVION-annoksen. Tarvitsemasi IDELVION-valmisteen määrä ja hoidon kesto riippuvat:
- sairautesi vaikeusasteesta
- verenvuodon sijainnista ja voimakkuudesta
- voinnistasi ja vasteestasi
- painostasi.
IDELVION annetaan injektiona laskimoon sen jälkeen, kun lääkäri tai sairaanhoitaja on sekoittanut kuiva-aineen pakkauksessa olevan liuottimen kanssa. IDELVION-injektion voi antaa laskimoon myös itse tai toinen henkilö sen jälkeen, kun pistoksen antoon on perehdytetty.
Jos käytät enemmän IDELVION-valmistetta kuin sinun pitäisi
Ota heti yhteys lääkäriin, jos pistät IDELVION-valmistetta enemmän kuin lääkäri on suositellut.
Jos lopetat IDELVION-valmisteen käytön
Älä lopeta IDELVION-valmisteen käyttöä keskustelematta asiasta ensin lääkärin kanssa.
Valmisteen käyttökuntoon saattaminen ja anto
Yleiset ohjeet
- Kuiva-aine on sekoitettava liuottimen (nesteen) kanssa ja vedettävä injektiopullosta ruiskuun niin, että lääke pysyy steriilinä (siihen ei pääse bakteereita). Lääkäri näyttää, miten liuos valmistetaan ja miten liuos vedetään injektiopullosta ruiskuun oikeaoppisesti.
- IDELVION-valmistetta ei saa sekoittaa muiden lääkevalmisteiden tai liuottimien kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Pakkauksen sisältö ja muuta tietoa.
- Liuoksen on oltava kirkasta tai hieman opaalinhohtoista, keltaista tai väritöntä eli se saattaa välkehtiä hieman valoa vasten katsottuna, mutta siinä ei saa olla silmämääräisesti havaittavia hiukkasia. Liuos on tarkistettava suodattamisen tai ruiskuun vetämisen (ks. seuraavassa) jälkeen silmämääräisesti, ennen kuin se käytetään. Älä käytä liuosta, jos se on sameaa tai jos siinä on hiukkasia tai hiutaleita.
- Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten ja lääkärin antamien ohjeiden mukaisesti.
Käyttökuntoon saattaminen
Ennen kuin avaat injektiopulloja, anna IDELVION-kuiva-aineen ja nesteen lämmetä huoneen- tai ruumiinlämpöiseksi. Tämä voidaan tehdä joko antamalla injektiopullojen olla huoneenlämmössä noin tunnin ajan tai pitämällä niitä kädessä muutaman minuutin ajan.
ÄLÄ altista injektiopulloja suoralle lämmölle. Injektiopulloja ei saa lämmittää kehon lämpötilaa (37 °C) lämpimämmäksi.
Poista injektiopulloista varovasti suojakorkki ja puhdista paljastuneet kumitulpat desinfiointipyyhkeellä. Anna injektiopullojen kuivua ennen kuin avaat Mix2Vial-pakkauksen (joka sisältää suodattimella varustetun siirtolaitteen). Noudata sitten seuraavia ohjeita.
|
 1 1
|
1. Avaa Mix2Vial vetämällä suojakansi pois. Älä poista Mix2Vial-laitetta läpipainopakkauksesta!
|
|
 2 2
|
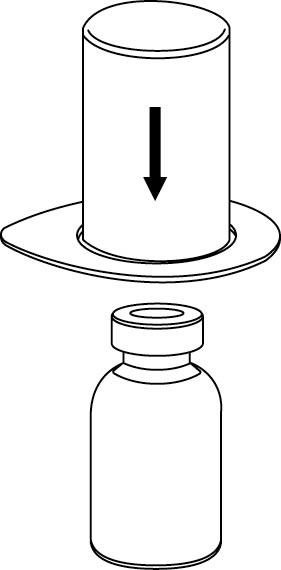
2. Aseta liuottimen sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial sekä pakkaus ja paina sinisen sovittimen piikki kohtisuoraan liuotinpullon tulpan läpi.
|
|
 3 3
|
3. Poista pakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain pakkauksen etkä Mix2Vial-laitetta.
|
|
 4 4
|
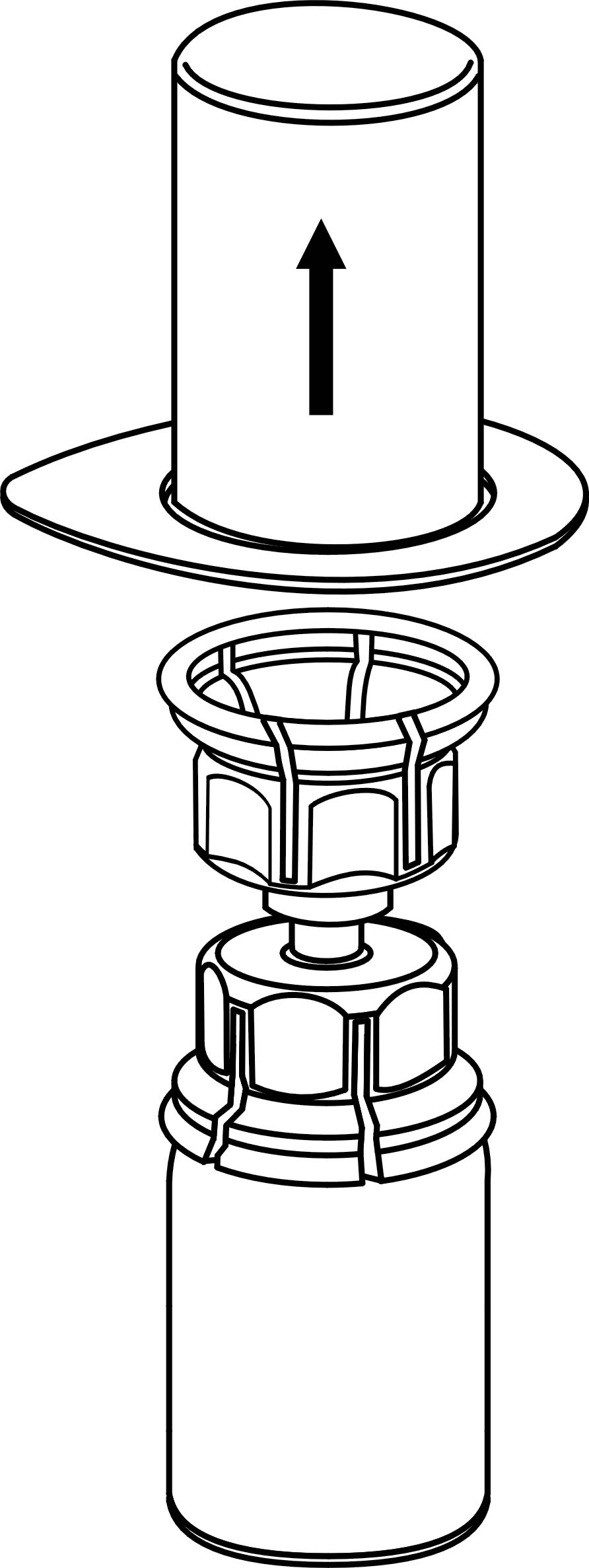
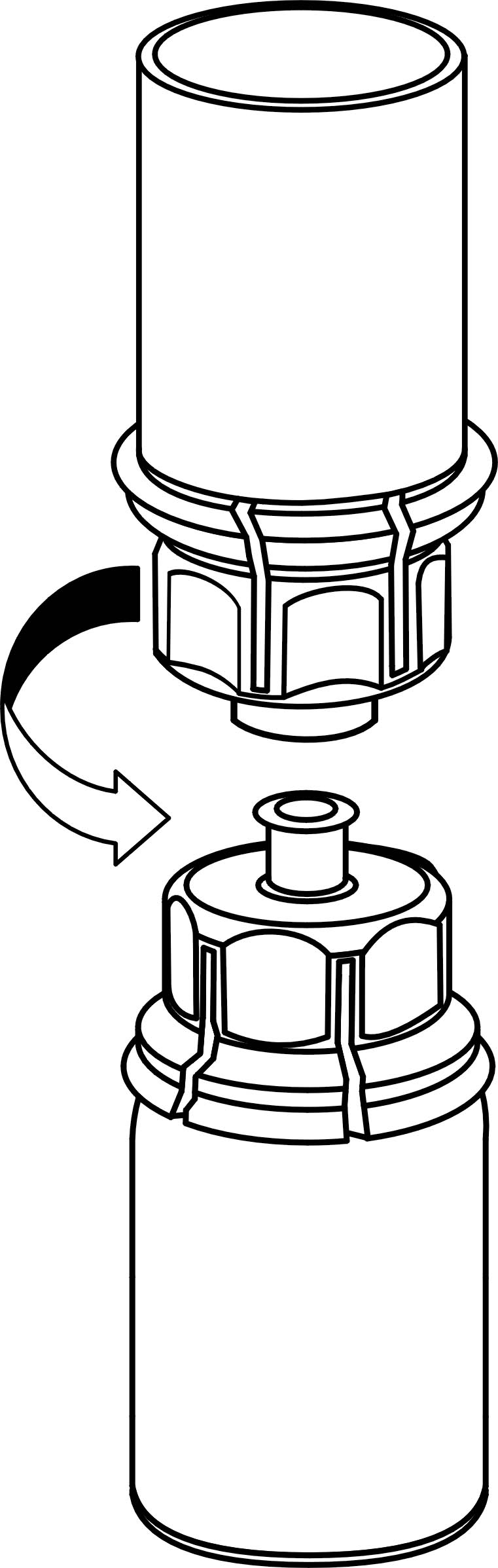
4. Aseta IDELVION-valmisteen kuiva-aineen sisältävä injektiopullo tasaiselle ja tukevalle alustalle. Kun liuottimen sisältävä injektiopullo on kiinnitettynä Mix2Vial-laitteeseen, käännä ne ylösalaisin ja paina läpinäkyvän sovittimen piikki suoraan IDELVION-valmisteen sisältävän injektiopullon kumitulpan läpi. Liuotin siirtyy automaattisesti IDELVION-valmisteen sisältävään injektiopulloon.
|
|
 5 5
|
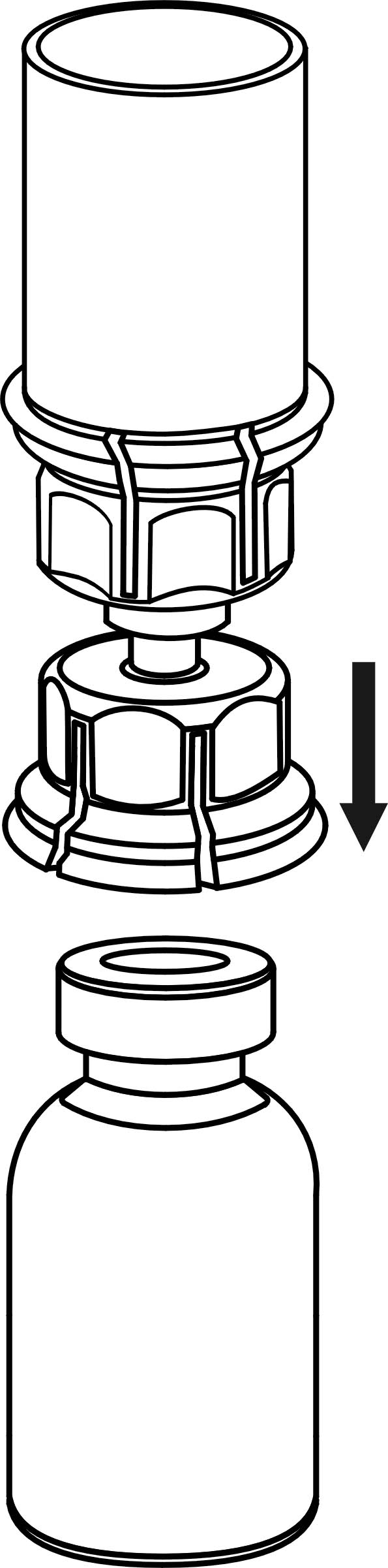
5. Ota toisella kädellä kiinni Mix2Vial-laitteen kuiva-aineen sisältävän injektiopullon puolelta ja toisella kädellä liuottimen sisältävän injektiopullon puolelta ja kierrä vastapäivään laite kahteen osaan varovasti. Hävitä liuotinpullo ja siihen kiinnitetty sininen Mix2Vial-sovitin.
|
|
 6 6
|
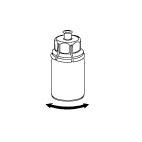
6. Pyörittele IDELVION-valmisteen sisältävää injektiopulloa ja siihen kiinnitettyä läpinäkyvää sovitinta varovasti, kunnes kuiva-aine on liuennut täysin. Älä ravista.
|
|
 7 7
|
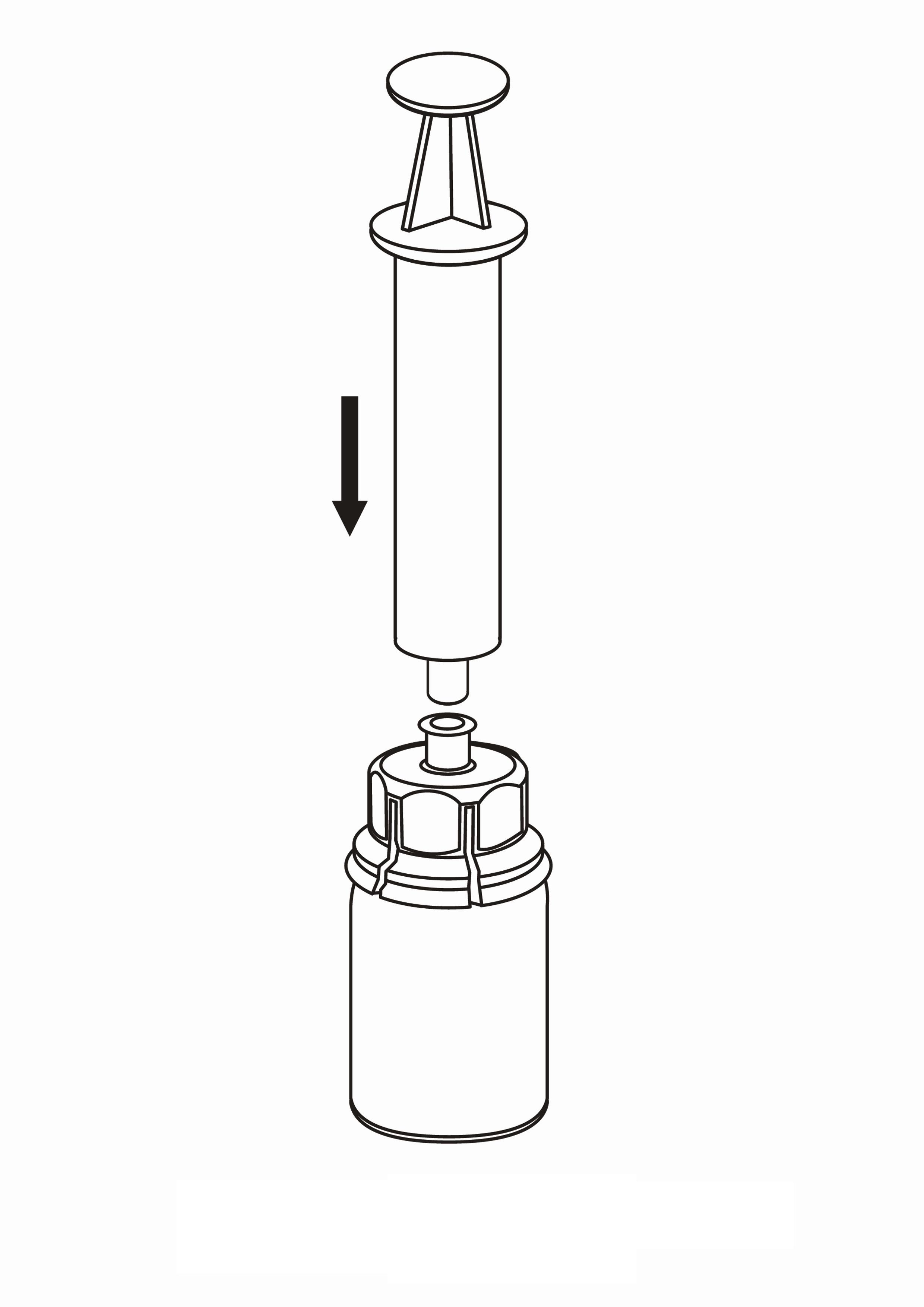
7. Vedä tyhjään, steriiliin ruiskuun ilmaa. Kun IDELVION-valmisteen sisältävä injektiopullo on oikeinpäin, kiinnitä ruisku Mix2Vial-sovittimen Luer Lock ‑liittimeen kiertämällä myötäpäivään. Ruiskuta ilma IDELVION-valmisteen sisältävään injektiopulloon.
|
Valmisteen vetäminen ruiskuun ja anto
|
 8 8
|
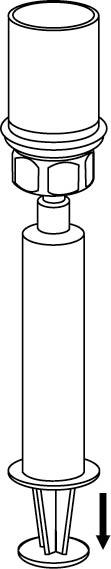
8. Kun ruiskun mäntä on sisään painettuna, käännä laite ja injektiopullo ylösalaisin ja vedä liuos ruiskuun vetämällä mäntää hitaasti ulospäin.
|
|
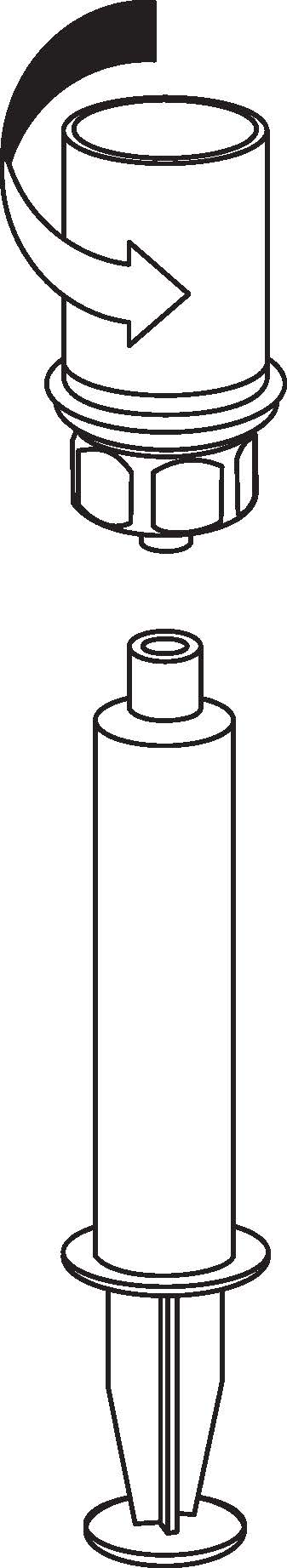 9 9
|
9. Kun liuos on nyt siirretty ruiskuun, ota tukeva ote ruiskun kammiosta (pitäen ruiskun mäntää samalla alaspäin) ja irrota läpinäkyvä Mix2Vial-sovitin ruiskusta kiertämällä vastapäivään.
|
Ota pakkauksen sisältämä laskimopunktiopakkaus ja työnnä neula laskimoon. Anna veren virrata putken takaosaan saakka. Kiinnitä ruisku laskimopunktiopakkauksen kierteillä varustettuun lukituspäähän. Injisoi käyttökuntoon saatettu liuos hitaasti (sinulle sopivalla tahdilla; enintään 5 ml/min) laskimoon lääkärin antaminen ohjeiden mukaisesti. Varmista, että lääkevalmisteen sisältävään ruiskuun ei pääse verta.
Tarkkaile välittömien haittavaikutusten ilmaantumista. Jos sinulle ilmaantuu IDELVION-valmisteen antoon mahdollisesti liittyviä haittavaikutuksia, injektion anto on lopetettava (ks. myös kohdat Mitä sinun on tiedettävä ennen valmisteen käyttöä ja Mahdolliset haittavaikutukset).
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Ota heti yhteyttä lääkäriin:
- jos huomaat allergisen reaktion oireita (ks. jäljempänä)
- jos huomaat, ettei lääke enää vaikuta riittävästi.
Seuraavia haittavaikutuksia on havaittu tekijä IX ‑lääkkeillä:
- Allergistyyppiset yliherkkyysreaktiot ovat mahdollisia (yleisiä) ja niiden oireita voivat olla: nokkosihottuma, ihottumat (yleistynyt nokkosihottuma), puristuksen tunne rinnassa, hengityksen vinkuminen, matala verenpaine (hypotensio) ja anafylaksia (vakava allerginen reaktio, josta aiheutuu vaikea-asteisia hengitysvaikeuksia tai huimausta). Jos tällaista ilmaantuu, lopeta lääkkeen käyttö heti ja ota yhteyttä lääkäriin.
- Vasta-aineet: Lääke ei enää vaikuta riittävästi (jatkuvia verenvuotoja). Sinulle saattaa kehittyä inhibiittoreita (neutralisoivia vasta-aineita) tekijä IX:ää kohtaan (esiintymistiheys tuntematon), jolloin tekijä IX ei enää vaikuta riittävästi. Jos näin käy, lopeta lääkkeen käyttö heti ja ota yhteyttä lääkäriin.
Seuraavat haittavaikutukset ovat yleisiä IDELVION-valmisteella (saattavat esiintyä enintään 1 henkilöllä 10:stä):
- Päänsärky
- Pistoskohdan reaktiot
- Heitehuimaus
- Ihottuma
Seuraavat haittavaikutukset ovat melko harvinaisia (saattavat esiintyä enintään 1 henkilöllä 100:sta):
Haittavaikutukset lapsilla ja nuorilla
Lapsilla esiintyvät haittavaikutukset ovat oletettavasti samanlaisia kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä etiketissä ja kotelossa mainitun viimeisen käyttöpäivämäärän jälkeen.
- Säilytä alle 25 °C.
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
- Käyttökuntoon saatettu valmiste on käytettävä mieluiten heti.
- Jos käyttökuntoon saatettua valmistetta ei käytetä heti, säilytysajat ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla.
6. Pakkauksen sisältö ja muuta tietoa
Mitä IDELVION sisältää
Vaikuttava aine on:
250 IU injektiopullo; kun valmiste on saatettu käyttökuntoon 2,5 ml:lla injektionesteisiin käytettävää vettä, liuos sisältää 100 IU/ml albutrepenonakogi alfaa.
500 IU injektiopullo; kun valmiste on saatettu käyttökuntoon 2,5 ml:lla injektionesteisiin käytettävää vettä, liuos sisältää 200 IU/ml albutrepenonakogi alfaa.
1000 IU injektiopullo; kun valmiste on saatettu käyttökuntoon 2,5 ml:lla injektionesteisiin käytettävää vettä, liuos sisältää 400 IU/ml albutrepenonakogi alfaa.
2000 IU injektiopullo; kun valmiste on saatettu käyttökuntoon 5 ml:lla injektionesteisiin käytettävää vettä, liuos sisältää 400 IU/ml albutrepenonakogi alfaa.
3500 IU injektiopullo; kun valmiste on saatettu käyttökuntoon 5 ml:lla injektionesteisiin käytettävää vettä, liuos sisältää 700 IU/ml albutrepenonakogi alfaa.
Muut aineet ovat:
Natriumsitraatti, polysorbaatti 80, mannitoli, sakkaroosi ja kloorivetyhappo (pH:n säätämiseen)
Katso viimeinen kappale kohdassa Mitä sinun on tiedettävä ennen valmisteen käyttöä.
Liuotin: Injektionesteisiin käytettävä vesi
Lääkevalmisteen kuvaus ja pakkauskoot
IDELVION on vaaleankeltainen tai valkoinen injektio-kuiva-aine ja pakkauksessa on mukana liuotin, joka on injektionesteisiin käytettävä vesi.
Käyttökuntoon saatettu liuos on kirkasta tai hieman opaalinhohtoista, keltaista tai väritöntä eli se saattaa välkehtiä hieman valoa vasten katsottuna, mutta siinä ei saa olla silmämääräisesti havaittavia hiukkasia.
Pakkauskoot
Yksi 250, 500 tai 1 000 IU pakkaus sisältää:
1 injektiopullo kuiva-ainetta
1 injektiopullo, joka sisältää 2,5 ml injektionesteisiin käytettävää vettä
1 suodattimella varustettu siirtolaite 20/20
Sisäpakkaus, joka sisältää:
1 kertakäyttöinen 5 ml:n ruisku
1 laskimopunktiosetti
2 desinfektiopyyhettä
1 ei-steriili laastari
Yksi 2 000 tai 3500 IU pakkaus sisältää:
1 injektiopullo kuiva-ainetta
1 injektiopullo, joka sisältää 5 ml injektionesteisiin käytettävää vettä
1 suodattimella varustettu siirtolaite 20/20
Sisäpakkaus, joka sisältää:
1 kertakäyttöinen 10 ml:n ruisku
1 laskimopunktiosetti
2 desinfektiopyyhettä
1 ei-steriili laastari
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi
CSL Behring AB
Puh: +46 8 544 966 70
Tämä pakkausseloste on tarkistettu viimeksi 02/2023
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu /.
Ohjeet terveydenhuollon ammattilaiselle
Annostus
Annos ja korvaushoidon kesto riippuvat tekijä IX:n puutteen vakavuudesta, vuotokohdasta ja vuodon laajuudesta sekä potilaan kliinisestä tilasta.
Annettavan tekijä IX yksikköjen määrä ilmoitetaan kansainvälisinä yksikköinä (IU), jotka ovat WHO:n voimassa olevan tekijä IX -valmisteiden standardin mukaisia. Tekijä IX:n aktiivisuus plasmassa ilmaistaan joko prosentteina (suhteessa normaaliin ihmisplasmaan) tai kansainvälisinä yksikköinä (suhteessa plasman hyytymistekijä IX:n kansainväliseen standardiin).
Tekijä IX:n yksi kansainvälinen yksikkö (IU) vastaa tekijä IX:n määrää 1 ml:ssa normaalia ihmisen plasmaa.
Hoito tarvittaessa
Hyytymistekijä IX:n tarvittavan annoksen laskeminen perustuu empiiriseen havaintoon, jonka mukaan 1 IU hyytymistekijä IX:ää painokiloa kohti lisää plasman hyytymistekijä IX:n aktiivisuutta keskimäärin 1,3 IU:lla/dl (1,3 %:lla normaalista aktiivisuudesta) 12-vuotiailla ja vanhemmilla potilailla ja 1,0 IU:lla/dl (1,0 %:lla normaalista aktiivisuudesta) alle 12-vuotiailla potilailla. Tarvittava annos määritetään seuraavan kaavan avulla:
Tarvittava annos (IU) = paino (kg) x haluttu tekijä IX:n pitoisuuden nousu (% normaalista aktiivisuudesta tai IU/dl) x {havaitun saannon [ns. in vivo recovery] käänteisarvo (IU/kg per IU/dl)}
Odotettu tekijä IX:n pitoisuuden nousu (IU/dl tai % normaalista aktiivisuudesta) = Annos (IU) x Saanto [ns. in vivo recovery] (IU/dl per IU/kg)/paino (kg)
Annos ja antotiheys pitää aina määrittää potilaskohtaisesti kliinisen vaikuttavuuden mukaan.
Alle 12-vuotiaat potilaat
Inkrementaaliselle saannolle (ns. incremental in vivo recovery), jossa 1 IU/dl on 1 IU/kg:aa kohti, annos lasketaan seuraavalla tavalla:
Tarvittava annos (IU) = paino (kg) x haluttu tekijä IX:n pitoisuuden nousu (IU/dl) x 1 dl/kg
Esimerkki
- 20 kg:n painoiselle vaikeaa B-hemofiliaa sairastavalle potilaalle vaadittava huippupitoisuus on 50 % normaalista aktiivisuudesta. Sopiva annos olisi 20 kg x 50 IU/dl x 1 dl/kg = 1 000 IU.
- Jos 1 000 IU:n annos IDELVION-valmistetta annetaan 25 kg:n painoiselle potilaalle, odotettu tekijä IX:n pitoisuuden nousu injektion jälkeen on enintään 1 000 IU/25 kg x 1,0 (IU/dl per IU/kg) = 40 IU/dl (40 % normaalista aktiivisuudesta).
Vähintään 12-vuotiaat potilaat
Inkrementaaliselle saannolle [ns. incremental in vivo recovery], jossa 1,3 IU/dl on 1 IU/kg:aa kohti, annos lasketaan seuraavalla tavalla:
Tarvittava annos (IU) = paino (kg) x haluttu tekijä IX:n pitoisuuden nousu (IU/dl) x 0,77 dl/kg
Esimerkki
- 80 kg:n painoiselle vaikeaa B-hemofiliaa sairastavalle potilaalle vaadittava huippupitoisuus on 50 % normaalista aktiivisuudesta. Sopiva annos olisi 80 kg x 50 IU/dl x 0,77 dl/kg = 3 080 IU.
- Jos 2 000 IU:n annos IDELVION-valmistetta annetaan 80 kg:n painoiselle potilaalle, odotettu tekijä IX:n pitoisuuden nousu injektion jälkeen on enintään 2 000 IU x 1,3 (IU/dl per IU/kg)/80 kg = 32,5 IU/dl (32,5 % normaalista aktiivisuudesta).
Seuraavissa verenvuototapahtumissa hyytymistekijä IX:n aktiivisuus ei saa laskea ilmoitetun plasman aktiivisuustason alapuolelle (prosentteina normaalista tai IU/dl) vastaavalla ajanjaksolla. Seuraavaa taulukkoa voidaan käyttää annostelun apuna verenvuodoissa ja leikkauksissa:
|
Vuodon voimakkuus / Kirurginen toimenpide
|
Tarvittava hyytymistekijä IX:n pitoisuus (%) (IU/dl)
|
Antotiheys (tuntia) / Hoidon kesto (vrk)
|
|
Verenvuoto
Lievä tai kohtalainen verenvuoto niveleen, lihakseen (pois lukien lonkankoukistaja) tai suun limakalvovuoto
|
30–60
|
Kerta-annos voi olla riittävä suurimmassa osassa tapauksista. Ylläpitoannos 24–72 tunnin kuluttua, jos vuoto jatkuu.
|
|
Laaja verenvuoto
Hengenvaarallinen verenvuoto, syvä lihasverenvuoto mukaan lukien lonkankoukistaja
|
60–100
|
Toista 24–72 tunnin välein ensimmäisen viikon ajan. Tämän jälkeen ylläpitoannos kerran viikossa, kunnes vuoto lakkaa ja haava paranee.
|
|
Pieni leikkaus
mukaan lukien komplisoitumaton hampaan poisto
|
50–80 (ennen leikkausta ja sen jälkeen)
|
Kerta-annos voi olla riittävä suurimmassa osassa pienistä leikkauksista. Tarvittaessa voidaan antaa ylläpitoannos 24–72 tunnin kuluttua, kunnes vuoto lakkaa tai vaurio paranee.
|
|
Suuri leikkaus
|
60–100 (ennen leikkausta ja sen jälkeen)
|
Toista 24–72 tunnin välein ensimmäisen viikon ajan. Tämän jälkeen ylläpitoannos 1–2 kertaa viikossa, kunnes vuoto lakkaa ja vaurio paranee.
|
Estohoito
Vaikeaa B-hemofiliaa sairastavien potilaiden verenvuodon pitkäaikaisessa estohoidossa tavanomainen annostus on 35–50 IU/kg kerran viikossa.
Joillekin potilaille, joiden sairaus pysyy hyvin hallinnassa kerran viikossa annettavalla hoidolla, voi sopia hoidoksi enintään 75 IU/kg ‑annos 10 tai 14 päivän välein. Yli 18-vuotiaille potilaille voidaan harkita vielä pidempää antoväliä.
Joissakin tapauksissa, erityisesti nuoria potilaita hoidettaessa, lyhyempi antoväli tai suurempi annos voi olla tarpeen.
Estohoidon aikana esiintyneen verenvuotojakson jälkeen estohoitoa jatketaan mahdollisimman tarkasti samalla annostuksella, mutta potilaalle annetaan kaksi IDELVION-annosta. Antovälin on oltava vähintään 24 tuntia, mutta se voi olla pidempikin, jos tämä on potilaan kannalta parempi.
Pediatriset potilaat
Pitkäaikaisessa estohoidossa suositeltu annostus on 35–50 IU/kg kerran viikossa. Annossuositukset vähintään 12-vuotiaille nuorille ovat samat kuin aikuisille (ks. edellä).
Varoitukset ja käyttöön liittyvät varotoimet
Inhibiittorit
Kun potilaita on hoidettu toistuvasti ihmisen hyytymistekijä IX ‑valmisteilla, heitä on tarkkailtava neutraloivien vasta-aineiden (inhibiittorien) varalta, jotka pitää määrittää Bethesda-yksiköinä (BU) käyttämällä soveltuvaa biologista testausta.
Kirjallisuudessa on raportteja, joissa osoitetaan korrelaatio tekijä IX:n inhibiittorien ja allergisten reaktioiden esiintymisen välillä. Siksi kaikilta allergisia reaktioita saavilta potilailta pitää tutkia inhibiittorin esiintyminen. On huomattava, että potilailla, joilla esiintyy tekijä IX:n inhibiittoreita, saattaa olla suurentunut anafylaksiariski myöhemmän hyytymistekijä IX:n käytön yhteydessä.
Hoidon seuranta
Hoidon aikana tekijä IX:n tasojen asianmukainen määrittäminen on suositeltavaa, jotta saadaan ohjeistusta käytettävästä annoksesta ja toistuvien infuusioiden antotiheydestä. Potilaskohtaiset vasteet tekijä IX:lle saattavat vaihdella, joten puoliintumisaika ja saanto (ns. in vivo recovery) voivat olla erilaiset. Kehon painoon perustuvaa annosta saatetaan joutua muuttamaan alipainoisille tai ylipainoisille potilaille. Erityisesti suurten kirurgisten toimenpiteiden yhteydessä on korvaushoidon tarkka seuranta koagulaatioanalyysin (plasman hyytymistekijä IX:n aktiivisuus) avulla välttämätöntä.
Kun potilaiden verinäytteiden tekijä IX:n aktiivisuuden määritykseen käytetään in vitro tromboplastiiniaikaan (aPTT) perustuvaa yksivaiheista hyytymismääritystä, sekä määrityksessä käytettävä aPTT-reagenssityyppi että vertailustandardi voivat vaikuttaa merkittävästi plasman tekijä IX:n aktiivisuustuloksiin. Jos yksivaiheisessa hyytymistestissä käytetään kaoliinipohjaista aPTT-reagenssia tai Actin FS aPTT-reagenssia, aktiivisuustulokset ovat todennäköisesti aliarvioituja. Tämä on huomioitava erityisesti silloin, kun laboratoriota ja/tai määrityksessä käytettäviä reagensseja vaihdetaan.