OCTANINE 100 IU/ml, 1000 IU injektiokuiva-aine ja liuotin, liuosta varten
Ihmisen veren hyytymistekijä IX
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä OCTANINE on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät OCTANINE-valmistetta
- Miten OCTANINE-valmistetta käytetään
- Mahdolliset haittavaikutukset
- OCTANINE-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
OCTANINE kuuluu lääkeryhmään, joita kutsutaan hyytymistekijöiksi ja sisältää ihmisen veren hyytymistekijää IX. Se on erityinen proteiini, joka lisää veren hyytymiskykyä.
OCTANINE-valmistetta käytetään verenvuodon hoitoon tai ehkäisemiseen potilailla, joilla on verenvuototauti (hemofilia B). Se on lääketieteellinen tila, jossa verenvuoto voi kestää pidempään kuin normaalisti. Se johtuu synnynnäisestä hyytymistekijä IX puutoksesta veressä.
OCTANINE toimitetaan injektiokuiva-aineena ja liuottimena liuoksen valmistamista varten. Valmiiksi sekoittamisen jälkeen OCTANINE-liuos annostellaan laskimoon (injektoidaan laskimoon).
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä OCTANINE-valmistetta
- jos olet allerginen ihmisen veren hyytymistekijälle IX tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on hepariinin aiheuttama tyypin II trombosytopenia, joka on verihiutaleiden määrän vähenemistä veressä hepariinin annon jälkeen. Verihiutaleet ovat veren soluja, jotka auttavat verenvuotoa loppumaan. Hepariini on lääke, jota käytetään estämään veren hyytymistä.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät OCTANINE-valmistetta.
- Kuten kaikkien laskimoon annettavien proteiineja sisältävien lääkevalmisteiden yhteydessä, allergistyyppiset yliherkkyysreaktiot ovat mahdollisia. OCTANINE sisältää hyvin pieniä määriä ihmisen muitakin proteiineja kuin tekijää IX ja hepariinia. Yliherkkyysreaktion varhaisia merkkejä ovat:
- nokkosihottuma
- ihottuma
- ahdistus rinnassa
- hengityksen vinkuminen
- verenpaineen lasku
- akuutti, vakava allerginen reaktio (anafylaksia, kun mikä tahansa tai kaikki yllä olevista oireista kehittyy nopeasti tai on voimakas).
Jos näitä oireita esiintyy, lopeta injektio välittömästi ja ota yhteyttä lääkäriisi. Anafylaktisen sokin ollessa kyseessä hän aloittaa suositellun hoidon niin nopeasti kuin mahdollista.
- Lääkärisi saattaa suositella, että harkitset rokotusta hepatiitti A:ta ja B:tä vastaan, jos saat säännöllisesti/toistuvasti ihmisen plasmasta saatuja tekijä IX -valmisteita.
- Tiedetään, että hemofilia B -potilailla voi muodostua imusolujen muodostamia inhibiittoreita (neutralisoivia vasta-aineita) tekijää IX vastaan. Inhibiittorit voivat lisätä anafylaktisen sokin mahdollisuutta (vakavia allergisia reaktioita). Jos sinulle tulee allerginen reaktio, tulisi sinulta tutkia inhibiittoreiden esiintymistä. Potilailla, joilla on tekijän IX inhibiittoreita saattaa olla suurentunut anafylaksiariski, jos heitä hoidetaan tekijällä IX. Sen takia lääkärisi saattaa päättää antaa ensimmäisen tekijä IX -injektion lääketieteellisessä valvonnassa, jolloin riittävä lääketieteellinen hoito allergisen reaktion varalle on olemassa.
- Tekijä IX -proteiinikonsentraatit saattavat aiheuttaa tukoksen verisuoniisi hyytymän avulla. Tämä riski on suurempi matalamman puhtausasteen valmisteilla. Tästä riskistä johtuen sinusta tulisi seurata verihyytymien muodostumisen merkkejä tekijä IX -valmisteiden annon jälkeen jos:
- sinulla on merkkejä fibrinolyysistä (hajonneita verihyytymiä)
- sinulla on disseminoitunut intravaskulaarinen koagulaatio (laajalle levinnyt veren hyytyminen verisuonistossa)
- sinulla on diagnosoitu maksasairaus
- sinulla on todettu sydän- ja verisuonitautien riskitekijöitä
- sinulle on tehty lähiaikoina leikkaus
- jos sinulla on suurempi hyytymien muodostumisriski tai suurempi riski disseminoituneeseen intravaskulaariseen koagulaatioon.
Jos sinulla on joku yllä olevista, lääkärisi antaa OCTANINE-valmistetta vain, jos saatava hyöty on suurempi kuin riskit.
- Toistuvan ihmisen hyytymistekijä IX -valmisteilla hoitamisen jälkeen potilailta tulisi seurata neutralisoivien vasta-aineiden (inhibiittoreiden) muodostumista. Niiden määrää tulisi mitata Bethesda-yksiköillä (BU) käyttäen sopivaa biologista testausta.
Verituotteiden virusturvallisuus
- Kun ihmisen verestä tai plasmasta tehdään lääkkeitä, tehdään tiettyjä toimenpiteitä, jotta estetään infektioiden siirtyminen potilaille. Näihin toimenpiteisiin kuuluu tarkka veren ja plasman luovuttajien valinta, jotta suljetaan pois ne, joilla on infektioriski, sekä virusten merkkien testaaminen jokaisesta luovutuksesta ja plasmaerästä. Näiden valmisteiden valmistajat myös sisällyttävät veren ja plasman valmistusprosessiin vaiheita, joilla voidaan inaktivoida tai poistaa viruksia. Näistä toimenpiteistä huolimatta, kun annetaan ihmisen verestä tai plasmasta tehtyjä lääkevalmisteita, ei voida täysin sulkea pois infektion siirtymisen mahdollisuutta. Tämä koskee myös tuntemattomia tai uusia viruksia tai muun tyyppisiä infektioita.
- Nämä toimenpiteet on todettu tehokkaiksi vaipallisiin viruksiin, kuten immuunikatoviruksiin (HIV), hepatiitti B -viruksiin ja hepatiitti C -viruksiin, sekä ei-vaipalliseen hepatiitti A-virukseen. Nämä toimenpiteet tehoavat vain rajoitetusti ei-vaipallisiin viruksiin kuten parvovirukseen B 19. Parvovirus B 19 -infektio voi olla vakava raskaana oleville naisille (sikiöinfektio) ja henkilöille, joiden immuunijärjestelmä on heikentynyt tai joilla on jonkinlainen anemia (esim. sirppisoluanemia tai hemolyyttinen anemia).
On erittäin suositeltavaa, että joka kerta kun saat annoksen OCTANINE-valmistetta, valmisteen nimi ja eränumero rekisteröidään, jotta käytetyistä eristä voidaan ylläpitää rekisteriä.
Lapset
Jos OCTANINE-valmistetta annetaan vastasyntyneelle, tulisi seurata tarkkaan disseminoituneen intravaskulaarisen koagulaation merkkejä.
Muut lääkevalmisteet ja OCTANINE
- Mitään yhteisvaikutuksia ihmisen veren hyytymistekijä IX -valmisteiden ja muiden lääkevalmisteiden välillä ei ole tiedossa.
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Tekijän IX käytöstä ei ole kokemusta raskauden tai imetyksen aikana. Tekijää IX tulee täten käyttää raskauden ja imetyksen aikana vain jos se on välttämätöntä.
Kysy lääkäriltä tai apteekista neuvoa ennen minkään lääkkeen käyttöä raskauden tai imetyksen aikana.
Ajaminen ja koneiden käyttö
Mitään vaikutuksia ajokykyyn ja kykyyn käyttää koneita ei ole havaittu.
OCTANINE sisältää natriumia
Tämä lääkevalmiste sisältää korkeintaan 138 mg natriumia (ruokasuolan pääainesoasa) yhtä OCTANINE 1000 IU -injektiopulloa kohden, mikä vastaa 6,9 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle. Tämä tulee ottaa huomioon, jos sinua on ohjeistettu noudattamaan vähäsuolaista ruokavaliota.
3. Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
OCTANINE annetaan laskimoon (injektoidaan laskimoon) sen jälkeen, kun se on tehty käyttövalmiiksi liuotinta lisäämällä.
Käytä ainoastaan mukana olevaa infuusiosettiä. Muiden injektio/infuusiolaitteiden käyttö voi aiheuttaa ylimääräisiä riskejä ja hoidon epäonnistumisen.
Hoito tulee aloittaa hemofilian hoitoon perehtyneen lääkärin valvonnassa. Se kuinka paljon OCTANINE-valmistetta käytät ja kuinka kauan korvaushoitoa jatketaan, riippuu tekijä IX -puutoksen vakavuudesta. Se riippuu myös vuotokohdasta ja vuodon vaikeusasteesta kuin myös kliinisestä tilastasi.
Annoksen laskeminen:
Lääkäri kertoo sinulle kuinka usein ja kuinka paljon OCTANINE-valmistetta sinun tarvitsee injektoida.
Tekijä IX –annos ilmaistaan kansainvälisinä yksikköinä (IU). Tekijä IX -aktiivisuus plasmassa vastaa plasmassa olevan tekijän IX määrää plasmassa. Se kerrotaan joko prosentteina (verrattuna normaaliin ihmisen veren plasmaan) tai kansainvälisinä yksikköinä (verrataan plasman tekijän IX kansainväliseen standardiin).
Yksi kansainvälinen yksikkö (IU) tekijä IX -aktiivisuutta vastaa tekijän IX määrää yhdessä millilitrassa normaalia ihmisen veren plasmaa. Tarvittavan tekijä IX –annoksen määrän laskeminen perustuu tehtyihin havaintoihin, joiden mukaan 1 IU tekijää kehon painokiloa kohden kohottaa veren plasman tekijä IX -aktiivisuutta 1 %:lla. Jotta voidaan laskea tarvitsemasi annos, mitataan tekijän IX aktiivisuus veriplasmastasi. Tämä osoittaa kuinka paljon aktiivisuutta tulee nostaa.
Tarvittava annos lasketaan seuraavan kaavan avulla:
Tarvittava yksikkömäärä = kehon paino (kg) x haluttu tekijän IX nousu (%)(IU/dl) x 0,8
Tarvittava annos ja antotiheys riippuu siitä kuinka reagoit lääkkeeseen ja sen ratkaisee lääkärisi. Hyytymistekijää IX tarvitsee vain harvoin annostella useammin kuin kerran päivässä.
Koska vasteesi tekijää IX kohtaan voi vaihdella, tarvittavan annoksen ja annostiheyden tulee perustua sinun tekijä IX -pitoisuuksien mittaamiseen hoitojakson aikana. Erityisesti leikkausten yhteydessä lääkärisi käyttää veritestejä (plasmatekijä IX –aktiivisuus) seuratakseen korvaushoitoja tarkasti.
Vuotojen ennaltaehkäisy:
Jos sinulla on vaikea hemofilia B, tulisi sinun pistää 20-40 IU tekijä IX:ää kehon painokiloa kohden. Pitkäaikaisessa estohoidossa sinun tulisi annostella tämä annos kaksi kertaa viikossa. Annos tulee säätää sinun vasteesi mukaisesti. Joissakin tapauksissa, erityisesti nuoremmille potilaille, voidaan tarvita tiheämpiä annosvälejä ja suurempia annoksia.
Käyttö lapsille
Tutkimuksessa, joka tehtiin alle 6-vuotiailla lapsilla, keskiarvoannos, joka annosteltiin altistuspäivää kohti, oli 40 IU/kg kehon painokiloa kohden.
Jos verenvuotoasi ei saada tyrehtymään inhibiittoreista johtuen:
Ilmoita lääkärille, jos odotettua tekijä IX -aktiivisuutta ei saada injektion jälkeen, tai verenvuoto ei tyrehdy oikean annoksen jälkeen. Hän tutkii veriplasmasi nähdäkseen onko sinulle kehittynyt inhibiittoreita (vasta-aineita) tekijä IX proteiinia vastaan. Tällaiset inhibiittorit voivat vähentää tekijä IX -aktiivisuutta. Siinä tapauksessa voi olla välttämätöntä valita toinen hoito. Lääkäri keskustelee asiasta kanssasi ja suosittelee jatkohoitoa, jos se on tarpeen.
Jos käytät enemmän OCTANINE-valmistetta kuin sinun pitäisi
Ihmisen hyytymistekijän IX kohdalla ei ole raportoitu yliannostuksesta johtuvista oireista. Suositeltua annosta ei kuitenkaan tule ylittää.
Lue kotihoito-ohjeet laitepakkauksen kotelosta.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
- Yliherkkyys- tai allergisia reaktioita on harvoin havaittu potilailla joita on hoidettu tekijää IX sisältävillä tuotteilla. Niihin voi liittyä:
- tahatonta verisuonten supistelua, johon liittyy kasvojen, suun ja kurkun turvotusta
- polttelua ja kirvelyä infuusiokohdassa
- kylmänväristyksiä
- kuumotusta
- ihottumaa
- päänsärkyä
- nokkosihottumaa
- alhaista verenpainetta
- uneliaisuutta
- pahoinvointia
- levottomuutta
- nopeaa sydämen sykettä
- rinnan ahdistusta
- pistelyä
- oksentelua
- hengityksen vinkumista.
Joissakin tapauksissa nämä allergiset reaktiot voivat johtaa vakavaan reaktioon, jota kutsutaan anafylaksiaksi. Anafylaksiaan voi liittyä sokki. Nämä reaktiot liittyvät pääasiallisesti tekijä IX -inhibiittoreiden muodostumiseen. Jos sinulla on joku yllämainituista oireista, ota yhteyttä lääkäriin.
- Jos sinulla on hemofilia B, voi sinulle kehittyä neutralisoivia vasta-aineita (inhibiittoreita) tekijälle IX. Nämä vasta-aineet voivat estää lääkettäsi toimimasta kunnolla. Lääkäri keskustelee tästä kanssasi ja suosittelee jatkohoitoa, jos se on tarpeen.
Tutkimuksessa, joka tehtiin 25:llä hemofilia B:tä sairastavalla lapsella, joista kuutta potilasta ei oltu aikaisemmin hoidettu, ei inhibiittoreita havaittu tutkimuksen aikana. Injektioiden siedettävyys arvioitiin hyväksi tai erittäin hyväksi. Jotkut hemofilia B -potilaat, joilla on tekijän IX inhibiittoreita ja ovat immuunivastehoidossa ja jotka ovat saaneet allergisen reaktion, saivat nefroottisen syndrooman (vaikea munuaissairaus).
- Kuumetta voi esiintyä harvoissa tapauksissa.
- Matalan puhtausasteen tekijä IX -valmisteet saattavat harvoissa tapauksissa aiheuttaa verihyytymän verisuonessa. Tämä voi johtaa johonkin seuraavista komplikaatioista:
- sydäninfarkti
- laajalle levinnyt hyytyminen verisuonistossa (disseminoitunut intravaskulaarinen koagulaatio)
- verihyytymiä laskimoissa (laskimotromboosi)
- verihyytymiä keuhkoissa (keuhkoembolia).
Nämä haittavaikutukset ovat yleisempiä jos käytät alhaisemman puhtausasteen tekijä IX -tuotteita ja niitä esiintyy vain harvoin jos käytät hyvin puhdistettuja valmisteita kuten OCTANINE-valmistetta.
- Valmisteen sisältämä hepariini voi aiheuttaa äkillistä veren verihiutaleiden vähenemistä alle 100 000:een mikrolitraa kohti tai alle 50 %:iin lähtömäärästä. Tätä allergista reaktiota kutsutaan ”hepariinin indusoimaksi tyypin II trombosytopeniaksi". Harvoissa tapauksissa potilailla, jotka eivät aikaisemmin ole olleet yliherkkiä hepariinille, tämä verihiutaleiden väheneminen saattaa ilmetä 6-14 päivää hoidon aloittamisen jälkeen. Potilailla, jotka aikaisemminkin ovat olleet yliherkkiä hepariinille, muutos voi kehittyä muutaman tunnin kuluessa hoidon aloittamisen jälkeen.
Tähän vaikeampimuotoiseen verihiutaleiden vähenemiseen voi liittyä tai sitä voi seurata:
- verihyytymiä valtimoissa ja laskimoissa
- verisuonen tukkeutuminen muualta tulleen hyytymän johdosta
- vaikea veren hyytymishäiriö, jota kutsutaan konsumptiiviseksi koagulopatiaksi
- ihon kuolio injektioalueella
- kirpun pureman kaltainen verenvuoto
- purppuranvärisiä mustelmia
- tervamaisia ulosteita.
Jos havaitset näitä allergisia reaktioita, lopeta OCTANINE-injektiot välittömästi äläkä käytä jatkossa hepariinia sisältäviä valmisteita. Tästä harvinaisesta verihiutalevaikutuksesta johtuen lääkäri seuraa verihiutaleiden määrää, erityisesti hoidon alussa.
Siirtyvien aineiden turvallisuus: ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä (Varoitukset ja varotoimet).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Säilytä alle 25 °C.
Ei saa jäätyä.
Pidä injektiopullot ulkopakkauksessa. Herkkä valolle.
Älä käytä tätä lääkettä myyntipäällysmerkinnässä mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Valmis liuos suositellaan käytettäväksi välittömästi, mutta viimeistään 8 tunnin sisällä huoneenlämmössä (25 °C) säilytettynä.
Käytä OCTANINE vain yhdellä käyttökerralla. Älä käytä tätä lääkettä, jos huomaat sameita tai epätäydellisesti liuenneita liuoksia.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä OCTANINE sisältää
Vaikuttava aine on ihmisen veren hyytymistekijä IX.
Muut aineet ovat hepariini, natriumkloridi, natriumsitraatti, arginiinihydrokloridi ja lysiinihydrokloridi.
Lääkevalmisteen kuvaus ja pakkauskoot
- OCTANINE 100 IU ml, 1000 IU on injektiokuiva-aine ja liuotin liuosta varten, yksi injektiopullo sisältää nimellisesti 1000 IU ihmisen veren hyytymistekijää IX.
Valmiste sisältää noin 100 IU/ml ihmisen veren hyytymistekijää IX, kun se on saatettu käyttövalmiiksi lisäämällä 10 ml injektionesteisiin käytettävää vettä.
OCTANINE on valmistettu ihmisten luovuttamasta plasmasta.
Teho (IU) määritetään käyttäen Euroopan farmakopean hyytymismääritystä, verrattuna Maailman terveysjärjestön (WHO) kansainväliseen standardiin. OCTANINE-valmisteen spesifinen aktiviteetti on noin 100 IU/mg proteiinia.
Pakkauksen kuvaus:
OCTANINE myydään yhdistelmäpakkauksissa, jotka koostuvat kahdesta pahvirasiasta, jotka on liitetty yhteen muovikalvolla:
1 pahvirasia sisältää injektiopullon, jossa on injektiokuiva-ainetta liuosta varten, sekä pakkausselosteen.
Toinen pahvirasia sisältää injektiopullon, jossa on liuotin (injektionesteisiin käytettävä vesi);
10 ml OCTANINE 100 IU / ml, 1000 IU varten.
Pakkaus sisältää myös seuraavat terveydenhuollon apuvälineet:
- 1 välineistö laskimonsisäistä injektiota varten (1 siirtolaite, 1 infuusiovälineistö, 1 kertakäyttöinen ruisku)
- 2 desinfiointipyyhettä.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija:
Octapharma AB
SE-112 75 Tukholma
Ruotsi
Valmistaja:
Octapharma Pharmazeutika Produktionsges.m.b.H
Oberlaaer Strasse 235
A-1100 Wien, Itävalta
tai
Octapharma S.A.S.
70-72 Rue du Maréchal Foch
67380 Lingolsheim, Ranska
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja
Octapharma Nordic AB
Rajatorpantie 41 C
01640 Vantaa
Tämä pakkausseloste on tarkistettu viimeksi 8.3.2021.
Ohjeet käyttäjälle
Kotihoito-ohjeet
• Lue kaikki ohjeet ja noudata niitä huolellisesti!
• Koko alla kuvatun työvaiheen aikana tulee säilyttää steriiliys!
• Älä käytä OCTANINE-valmistetta etikettiin ja kotelossa merkityn viimeisen käyttöpäivän jälkeen.
• Tarkista käyttövalmiiksi saatettu lääkevalmiste ennen sen antamista silmämääräisesti ja varmista, ettei siinä ole näkyviä hiukkasia eikä värimuutoksia.
• Ruiskussa olevan liuoksen tulee olla kirkasta tai hieman läpikuultavaa. Älä käytä liuoksia, jotka ovat sameita tai joissa on hiukkasia.
• Valmis liuos on käytettävä välittömästi mikrobikontaminaation välttämiseksi.
• Käytä ainoastaan mukana olevia infuusiovälineitä. Muiden injektio-/infuusiolaitteiden käyttö saattaa lisätä riskejä ja aiheuttaa hoidon epäonnistumisen.
Ohjeet liuoksen valmistamiseksi:
- Älä käytä valmistetta heti jääkaapista ottamisen jälkeen. Anna liuottimen ja kuiva-aineen lämmetä suljetuissa injektiopulloissa huoneenlämpöisiksi.
- Irrota repäisykorkit molemmista injektiopulloista ja puhdista kummankin pullon kumitulppa pakkauksessa olevalla alkoholipyyhkeellä.
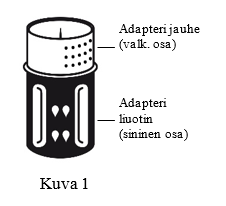
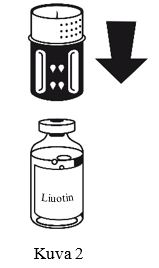
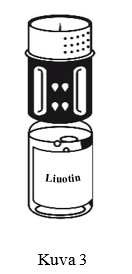
- Siirtolaite on esitetty kuvassa 1. Aseta liuotinpullo tasaiselle alustalle ja pidä siitä tukevasti kiinni. Ota siirtolaite ja käännä se ylösalaisin. Aseta sen sininen osa liuotinpulloa vasten ja paina tiukasti, kunnes kuulet napsahduksen (kuvat 2+3). Älä väännä osia kiinnittäessäsi niitä toisiinsa.
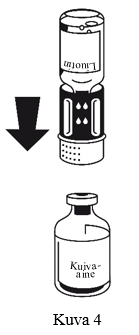
- Aseta kuiva-ainepullo tasaiselle alustalle ja pidä siitä tukevasti kiinni. Käännä liuotinpullo, johon siirtolaite on kiinnitetty, ylösalaisin. Aseta valkoinen osa kuiva-ainepulloa (jauhe) vasten ja paina lujasti, kunnes kuulet napsahduksen (kuva 4). Älä väännä osia kiinnittäessäsi niitä toisiinsa. Liuotin valuu automaattisesti kuiva-ainepulloon.
- Pidä molemmat injektiopullot edelleen kiinni toisissaan ja pyöritä kuiva-ainepulloa varovasti, kunnes valmiste on liuennut.
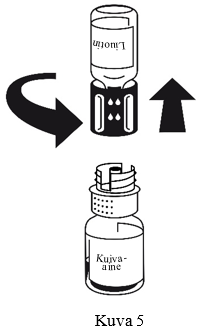
Injektiokuiva-aine liukenee huoneenlämmössä alle 10 minuutissa. Valmisteeseen voi muodostua hieman vaahtoa. Kierrä siirtolaite irti (kuva 5), jolloin vaahto häviää.
Hävitä tyhjä liuotinainepullo ja siinä oleva siirtolaitteen sininen osa.
Injisointiohjeet:
Pulssi on varmuuden vuoksi mitattava ennen lääkkeen injisointia ja sen aikana. Jos pulssi nousee selvästi, injektiota on hidastettava tai lääkkeen antaminen on keskeytettävä lyhyeksi aikaa.
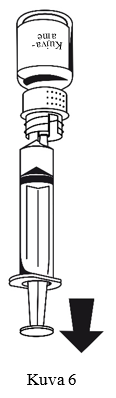
- Kiinnitä ruisku siirtolaitteen valkoiseen osaan. Käännä pullo ylösalaisin ja vedä liuos ruiskuun (kuva 6).
Liuoksen tulee olla kirkasta tai hieman läpikuultavaa.
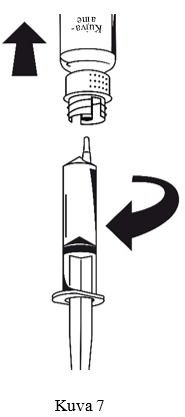
Kun liuos on siirretty, pidä ruiskun männästä tukevasti kiinni (ruisku edelleen ylösalaisin) ja irrota ruisku siirtolaitteesta (kuva 7). Hävitä tyhjä injektiopullo yhdessä siirtolaitteen valkoisen osan kanssa.
- Pyyhi aiottu injektiokohta pakkauksessa olevalla alkoholipyyhkeellä.
- Kiinnitä mukana oleva infuusiovälineistö ruiskuun.
- Työnnä neula ennalta valitsemaasi laskimoon. Jos olet käyttänyt kiristyssidettä suonen löytämiseksi, side tulee poistaa ennen OCTANINE-valmisteen injisointia. Ruiskuun ei saa päästä verta, sillä tällöin on vaarana fibriinihyytymien muodostuminen.
- Ruiskuta liuos hitaasti laskimoon. Injektionopeus: 2–3 ml minuutissa.
Jos käytät useamman OCTANINE-injektiokuiva-ainepullollisen yhden hoitokerran aikana, voit käyttää samaa neulaa ja ruiskua. Siirtolaite on tarkoitettu kertakäyttöön.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.