VaxigripTetra injektioneste, suspensio, esitäytetty ruisku
Influenssarokote (virusfragmentit, inaktivoitu)
Lisäseuranta
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin sinä saat tai lapsesi saa tämän rokotteen, sillä se sisältää tärkeitä tietoja sinulle tai lapsellesi.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle tai lapsellesi, eikä sitä tule antaa muiden käyttöön.
- Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä VaxigripTetra on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin sinulle tai lapsellesi annetaan VaxigripTetra-rokotus
- Miten VaxigripTetra-rokotetta käytetään
- Mahdolliset haittavaikutukset
- VaxigripTetra-rokotteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
VaxigripTetra on rokote. Tämä rokote, joka annetaan sinulle tai vähintään 6 kuukauden ikäiselle lapsellesi, suojaa sinua tai lastasi influenssaa vastaan.
Kun henkilölle annetaan VaxigripTetra-rokotus, immuunijärjestelmä (kehon luonnollinen puolustusjärjestelmä) tuottaa itse suojan (vasta-aineita) tautia vastaan. Kun rokote annetaan raskauden aikana, se suojaa raskaana olevaa naista ja myös hänen lastaan syntymästä enintään 6 kuukauden ikään asti, koska suoja siirtyy äidistä lapseen raskauden aikana (ks. myös kohdat Mitä sinun on tiedettävä ennen valmisteen käyttöä ja Miten valmistetta käytetään). Mikään rokotteen valmistusaineista ei voi aiheuttaa influenssaa.
VaxigripTetra-rokotteen käytön pitää perustua mahdollisiin virallisiin suosituksiin.
Influenssa on sairaus, joka voi levitä nopeasti ja jonka aiheuttajina on monia erityyppisiä viruskantoja, jotka vaihtelevat vuodesta toiseen. Johtuen tästä mahdollisesta leviävien kantojen vuosittaisesta muutoksesta, sekä rokotteen tarjoaman suojan tarkoitetusta kestosta, rokotteen ottamista suositellaan joka vuosi. Influenssaan sairastumisen riski on suurimmillaan kylminä kuukausina, lokakuusta maaliskuuhun. Jos sinua tai lastasi ei ole rokotettu syksyllä, rokotuksen antaminen on silti järkevää kevääseen saakka, koska tartunnan mahdollisuus on olemassa siihen asti. Lääkärisi pystyy suosittelemaan sinulle parhaan rokotusajankohdan.
VaxigripTetra on tarkoitettu suojaamaan sinua tai lastasi neljää rokotteen sisältämää viruskantaa vastaan noin 2–3 viikon kuluttua rokotuksen jälkeen. Jos sinä tai lapsesi altistutte kuitenkin influenssalle välittömästi ennen rokotusta tai sen jälkeen, sinulle tai lapsellesi voi kehittyä influenssasairaus, koska influenssan itämisaika on muutamia päiviä.
Rokote ei suojaa sinua tai lastasi tavalliselta nuhakuumeelta, vaikka jotkut sen oireista ovat hyvin samankaltaisia kuin influenssan oireet.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
VaxigripTetra-rokotteen sopivuuden varmistamiseksi on tärkeää, että kerrot lääkärille tai apteekkihenkilökunnalle, jos jokin seuraavista kohdista koskee sinua tai lastasi. Jos et ymmärrä jotain asiaa, pyydä lääkäriä tai apteekkihenkilökuntaa selittämään se.
Älä käytä VaxigripTetra-rokotetta
- jos sinä olet tai lapsesi on allerginen:
- vaikuttaville aineille tai
- tämän rokotteen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa) tai
- jollekin aineelle, jota rokotteessa voi olla hyvin pieniä määriä, kuten kananmunaa (ovalbumiinia tai kanan proteiineja), neomysiiniä, formaldehydiä tai oktoksinoli-9:ä.
- jos sinulla tai lapsellasi on sairaus, johon liittyy korkea tai kohtalainen kuume tai akuutti sairaus, rokotusta on lykättävä, kunnes sinä olet toipunut tai lapsesi on toipunut.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa, ennen kuin otat VaxigripTetra-rokotetta.
Sinun tulee kertoa lääkärillesi ennen rokotusta:
- jos sinun tai lapsesi immuunivaste on heikko (sinulla tai lapsellasi on immuunivajavuustila tai sinä käytät tai lapsesi käyttää immuunijärjestelmään vaikuttavia lääkkeitä)
- jos sinulla tai lapsellasi on verenvuoto-ongelma tai saat/lapsesi saa helposti mustelmia.
Lääkärisi päättää, voitko sinä tai lapsesi saada rokotteen.
Pyörtymistä voi esiintyä (lähinnä nuorilla) neulanpistoksen jälkeen tai jopa sitä ennen. Kerro sen vuoksi lääkärille tai hoitajalle, jos sinä tai lapsesi olette pyörtynyt edellisen pistoksen kohdalla.
Kaikkien muiden rokotteiden tavoin VaxigripTetra ei välttämättä anna täydellistä suojaa kaikille rokotetuille henkilöille.
Rokote ei suojaa kaikkia raskauden aikana rokotuksen saaneiden äitien alle 6 kuukauden ikäisiä lapsia.
Kerro lääkärillesi, jos sinulta tai lapseltasi otetaan jostakin syystä verikoe muutaman päivän kuluessa influenssarokotteen saamisen jälkeen. Tämä on tarpeen, sillä joillakin harvoilla potilailla verikokeiden tuloksissa on havaittu virheellisyyksiä, kun näyte on otettu pian rokotuksen jälkeen.
Lapset
VaxigripTetra-rokotetta ei suositella käytettäväksi alle 6 kuukauden ikäisille lapsille.
Muut lääkevalmisteet ja VaxigripTetra
Kerro lääkärille tai apteekkihenkilökunnalle jos sinä tai lapsesi parhaillaan käytät tai olet/lapsesi on äskettäin käyttänyt muita lääkkeitä tai saanut muita rokotteita.
- VaxigripTetra-rokote voidaan antaa samanaikaisesti muiden rokotteiden kanssa, kun pistos annetaan eri raajaan.
- Immunologinen vaste saattaa heikentyä, jos potilas saa immuunivastetta heikentävää hoitoa, kuten kortikosteroideja, solunsalpaajia tai sädehoitoa.
Raskaus ja imetys
Jos olet raskaana tai imetät tai epäilet olevasi raskaana, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
VaxigripTetra-rokotetta voi käyttää raskauden kaikissa vaiheissa.
VaxigripTetra-rokotteen voi antaa rintaruokinnan aikana.
Lääkäri/apteekkihenkilökunta päättää, voitko saada VaxigripTetra-rokotetta.
Ajaminen ja koneiden käyttö
VaxigripTetra-rokotteella ei ole vaikutusta ajokykyyn ja koneiden käyttökykyyn, tai vaikutus on merkityksettömän pieni.
VaxigripTetra sisältää kaliumia ja natriumia Tämä lääkevalmiste sisältää alle 1 mmol kaliumia (39 mg) ja alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”kaliumiton” ja ”natriumiton”.
3. Miten valmistetta käytetään
Annostus
Aikuiset saavat yhden 0,5 ml:n annoksen.
Käyttö lapsille
6 kuukauden – 17-vuoden ikäiset lapset saavat yhden 0,5 ml:n annoksen.
Jos lapsesi on alle 9-vuotias ja häntä ei ole rokotettu aiemmin influenssaa vastaan, toinen 0,5 ml:n annos pitäisi antaa aikaisintaan neljän viikon kuluttua ensimmäisestä annoksesta.
Jos olet raskaana, sinulle raskauden aikana annettu 0,5 ml:n annos voi suojata lastasi syntymästä enintään 6 kuukauden ikään asti. Kysy lääkäriltä tai apteekkihenkilökunnalta lisätietoja.
Miten VaxigripTetra annetaan
Lääkäri tai hoitaja antaa suositellun annoksen rokotetta pistoksena lihakseen tai ihon alle.
Jos sinä saat tai lapsesi saa enemmän VaxigripTetra-rokotetta kuin teidän pitäisi
Joissakin tapauksissa on vahingossa annettu enemmän kuin suositeltu annos.
Kun haittavaikutuksista näissä tapauksissa ilmoitettiin, ne vastasivat haittavaikutuksia, joita on kuvattu suositellun annoksen antamisen jälkeen (ks.kohta 4).
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin rokote voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Allergiset reaktiot
Ota välittömästi yhteyttä lääkäriin tai muuhun terveydenhuollon ammattilaiseen tai mene heti lähimpään päivystykseen, jos sinä saat tai lapsesi saa allergisia reaktioita (joita on ilmoitettu harvinaisina haittavaikutuksina: harvemmalla kuin yhdellä 1 000 henkilöstä), jotka voivat olla henkeä uhkaavia. Niiden oireita saattavat olla muun muassa ihottuma, kutina, nokkosihottuma, punoitus, hengitysvaikeudet, hengenahdistus, kasvojen, huulten, kurkun tai kielen turpoaminen, kylmä ja tahmea iho, sydämentykytys, huimaus, heikotus tai pyörtyminen.
Muita aikuisilla ja iäkkäillä henkilöillä ilmoitettuja haittavaikutuksia
Hyvin yleiset (vähintään yhdellä 10 henkilöstä):
- Päänsärky, lihaskipu, yleinen huonovointisuus (1), kipu pistoskohdassa.
(1) Yleinen iäkkäillä
Yleiset (harvemmalla kuin yhdellä 10 henkilöstä):
- Kuume (2), vilunväristykset, reaktiot pistoskohdassa: punoitus (eryteema), turvotus, kovuus (kovettuma).
(2) Melko harvinainen iäkkäillä
Melko harvinaiset (harvemmalla kuin yhdellä 100 henkilöstä):
- Huimaus (3), ripuli, pahoinvointi (4), väsymys, reaktiot pistoskohdassa: mustelma, kutina ja lämpö
(3) Harvinainen aikuisilla, (4) Harvinainen iäkkäillä
- Kuumat aallot: havaittu vain iäkkäillä
- Kaulassa, kainaloissa tai nivusissa olevien rauhasten turpoaminen (lymfadenopatia): havaittu vain aikuisilla.
Harvinaiset (harvemmalla kuin yhdellä 1 000 henkilöstä):
- Poikkeavuudet kosketuksen, kivun, lämmön ja kylmän aistimisessa (parestesia), uneliaisuus, lisääntynyt hikoilu (hyperhidroosi), epätavallinen väsymys ja heikotus (astenia), flunssan kaltainen sairaus
- Nivelkipu (artralgia), epämukava tunne pistoskohdassa: havaittu vain aikuisilla.
Muita haittavaikutuksia, joita on ilmoitettu 3–17-vuotiailla lapsilla
Hyvin yleiset (vähintään yhdellä 10 henkilöstä):
- Päänsärky, lihaskipu (myalgia), yleinen huonovointisuus (pahoinvointi), vilunväristykset (5), reaktiot pistoskohdassa: kipu, turvotus, punoitus (eryteema) (5), kovuus (kovettuma) (5).
(5) Yleinen 9–17-vuotiailla lapsilla
Yleiset (harvemmalla kuin yhdellä 10 henkilöstä):
- Kuume, mustelma pistoskohdassa (ekkymoosi).
Melko harvinaiset (harvemmalla kuin yhdellä 100 henkilöstä) 3–8-vuotiailla lapsilla :
- Tietyn tyyppisten, verihiutaleiksi kutsuttujen verihiukkasten tilapäinen väheneminen, niiden alhainen määrä voi johtaa mustelmien tai verenvuodon lisääntymiseen (ohimenevä verihiutalekato): havaittu vain yhdellä 3-vuotiaalla lapsella
- Vaikertaminen, levottomuus
- Huimaus, ripuli, oksentelu, ylävatsakipu, nivelkipu (artralgia), väsymys, lämpö pistoskohdassa.
Melko harvinaiset (harvemmalla kuin yhdellä 100 henkilöstä) 9–17-vuotiailla lapsilla :
- Ripuli, kutina pistoskohdassa.
Muita haittavaikutuksia, joita on ilmoitettu 6–35 kuukauden ikäisillä lapsilla
Hyvin yleiset (vähintään yhdellä 10 henkilöstä):
- Oksentelu (1), lihaskipu (myalgia) (2), ärtyneisyys (3), ruokahaluttomuus (3), yleinen huonovointisuus (2), kuume.
(1) Melko harvinainen 24–35 kuukauden ikäisillä lapsilla, (2) Harvinainen alle 24 kuukauden ikäisillä lapsilla, (3) Harvinainen 24–35 kuukauden ikäisillä lapsilla
- Reaktiot injektiokohdassa: kipu/arkuus, punoitus (eryteema).
- Päänsärky: havaittu vain yli 24 kuukauden ikäisillä lapsilla.
- Uneliaisuus, epätavallinen itku: havaittu vain alle 24 kuukauden ikäisillä lapsilla.
Yleiset (harvemmalla kuin yhdellä 10 henkilöstä):
- Vilunväristykset: havaittu vain 24 kuukauden ikäisillä ja sitä vanhemmilla lapsilla.
- Reaktiot injektiokohdassa: kovuus (kovettuma), turvotus, mustelma (ekkymoosi).
Melko harvinaiset (harvemmalla kuin yhdellä 100 henkilöstä):
Harvinaiset (harvemmalla kuin yhdellä 1 000 henkilöstä):
- Flunssan kaltainen sairaus, reaktiot injektiokohdassa: ihottuma, kutina.
6 kuukauden – 8-vuoden ikäisillä lapsilla, jotka saivat kaksi annosta, haittavaikutukset olivat samanlaisia ensimmäisen ja toisen annoksen jälkeen. 6–35 kuukauden ikäisillä lapsilla saattaa ilmetä vähemmän haittavaikutuksia toisen annoksen jälkeen.
Havaitut haittavaikutukset ilmenivät yleensä ensimmäisten kolmen vuorokauden sisällä rokotuksen jälkeen ja hävisivät itsestään 1–3 vuorokauden sisällä niiden alkamisesta. Nämä havaitut haittavaikutukset olivat voimakkuudeltaan lieviä.
Kaiken kaikkiaan haittavaikutuksia esiintyi yleisesti ottaen vähemmän iäkkäillä kuin aikuisilla ja lapsilla.
Seuraavista haittavaikutuksista on ilmoitettu Vaxigrip-rokotteen annon jälkeen. Näitä haittavaikutuksia voi esiintyä VaxigripTetra-rokotteen käytön yhteydessä:
- Hermoradalle sijoittuva kipu (neuralgia), kouristuskohtaukset, hermoston häiriöt, jotka saattavat aiheuttaa niskan jäykkyyttä, sekavuutta, puutumista, kipua ja heikkoutta raajoissa, tasapainohäiriöt, reaktiokyvyn häiriöt, koko kehon tai sen osan halvaantumista (enkefalomyeliitti, neuriitti, Guillain‑Barrén oireyhtymä)
- Verisuonitulehdus (vaskuliitti), joka voi aiheuttaa ihottumaa ja hyvin harvinaisissa tapauksissa tilapäisiä munuaisvaivoja.
- Ohimenevä verihiutalekato, lymfadenopatia, parestesia muissa kuin edellä näiden haittavaikutusten yhteydessä kuvatuissa ikäryhmissä.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai hoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA.
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä etiketissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen, joka on EXP-merkinnän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä. Pidä ruisku ulkopakkauksessa. Herkkä valolle.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä VaxigripTetra sisältää
- Vaikuttavat aineet ovat: Influenssavirus (inaktivoitu, fragmentoitu) seuraavista kannoista*:
Kannan A/Victoria/4897/2022 (H1N1)pdm09 kaltainen virus (A/Victoria/4897/2022 , IVR-238) 15 mikrogrammaa HA**
Kannan A/Croatia/10136RV/2023 (H3N2) kaltainen virus (A/Croatia/10136RV/2023, X-425A) 15 mikrogrammaa HA**
Kannan B/Austria/1359417/2021 kaltainen virus (B/Michigan/01/2021, villityyppi) 15 mikrogrammaa HA**
Kannan B/Phuket/3073/2013 kaltainen virus (B/Phuket/3073/2013, villityyppi) 15 mikrogrammaa HA**
0,5 ml:n annosta kohti
* kasvatettu terveiden kanojen hedelmöitetyissä kananmunissa
**hemagglutiniini
Rokote on WHO:n (Maailman terveysjärjestön) suositusten (pohjoinen pallonpuolisko) ja EU:n päätöksen mukainen kaudelle 2025-2026.
- Muut aineet ovat: Puskuriliuos, joka sisältää natriumkloridia, kaliumkloridia, dinatriumfosfaattidihydraattia, kaliumdihydrogeenifosfaattia, injektionesteisiin käytettävää vettä.
Joitakin ainesosia kuten kananmunaa (ovalbumiini, kanan proteiinit), neomysiiniä, formaldehydiä tai oktoksinoli-9:ää saattaa esiintyä hyvin pieninä määrinä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Lääkevalmisteen kuvaus ja pakkauskoot
Kevyen ravistamisen jälkeen suspensio on väritön ja opalisoiva.
VaxigripTetra on injektioneste, suspensio esitäytetyssä 0,5 ml:n ruiskussa kiinteällä neulalla tai ilman neulaa (pakkauskoot: 1, 10 tai 20) tai erillisellä turvaneulalla (pakkauskoot: 1 tai 10). Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
Ranska
Valmistaja
Sanofi Winthrop Industrie - 1541 avenue Marcel Mérieux - 69280 Marcy l'Etoile – Ranska
Sanofi Winthrop Industrie - Voie de l’Institut - Parc Industriel d'Incarville – B.P 101 - 27100 Val de Reuil – Ranska
Sanofi Aventis Zrt. - Campona utca 1. (Harbor Park) - 1225 Budapest – Unkari
Paikallinen edustaja:
Sanofi Oy
Revontulenkuja 1
02100 Espoo
Puh.: +358 (0) 201 200 300
Tämä pakkausseloste on tarkistettu viimeksi 27.05.2025
Muut tiedonlähteet
Viimeisimmät hyväksytyt tiedot tästä valmisteesta ovat saatavilla ulkopakkauksessa olevan QR-koodin kautta älypuhelimella tai osoitteessa https://vaxigriptetra-nh.info.sanofi
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille:
Kuten aina injektoitavia rokotteita annettaessa, pitää asianmukaisen hoidon ja valvonnan olla helposti saatavilla rokotuksen jälkeen mahdollisesti esiintyvän anafylaktisen tapahtuman varalta.
Rokotteen pitää antaa lämmetä huoneenlämpöiseksi ennen käyttöä.
Ravistettava ennen käyttöä. Tarkastettava silmämääräisesti ennen antoa.
Rokotetta ei saa käyttää, jos suspensiossa on vierashiukkasia.
Rokotetta ei saa sekoittaa samassa ruiskussa muiden lääkevalmisteiden kanssa.
Rokotetta ei saa antaa verisuoneen.
Katso myös kohta Miten valmistetta käytetään Miten VaxigripTetra-rokotetta käytetään.
<Valmistelut ennen antamista
Ohjeet turvaneulan käytölle esitäytetyn Luer Lock ‑ruiskun kanssa:
| Kuva A: Turvaneula (kotelossa) | Kuva B: Turvaneulan osat (valmisteltuna käyttöä varten) |
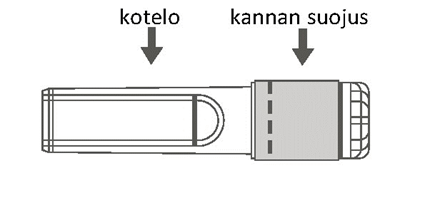 |  |
| Vaihe 1: Kiinnitä neula ruiskuun seuraavasti: Poista kannan suojus, niin että neulan kanta tulee näkyviin, ja kierrä neulaa varovasti ruiskun Luer Lock ‑liittimeen, kunnes tunnet vähäisen vastuksen. |
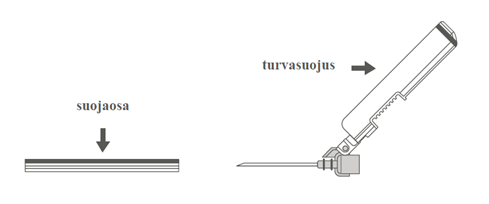
| Vaihe 2: Poista turvaneulan kotelo vetämällä kohtisuoraan. Neula on turvasuojuksen ja suojaosan sisällä. |
Vaihe 3: A: Käännä turvasuojusta poispäin neulasta, kohti ruiskun sylinteriä kuvassa esitettyyn asentoon. B: Poista suojaosa vetämällä kohtisuoraan. | 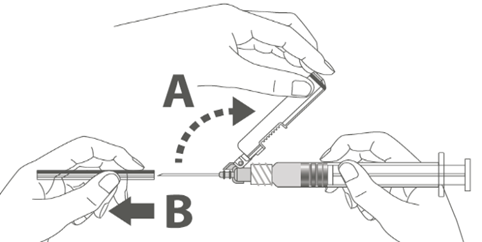 |
Vaihe 4: Kun pistos on annettu, lukitse (aktivoi) turvasuojus käyttämällä jotakin kolmesta (3) yhden käden tekniikasta, jotka on esitetty kuvassa, eli aktivoinnilla pintaa vasten, peukalolla tai sormella. Huomaa: Aktivointi on onnistunut, kun kuulet ja/tai tunnet naksahduksen. | 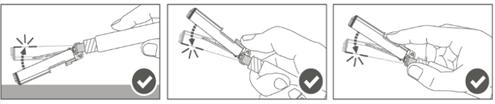 |
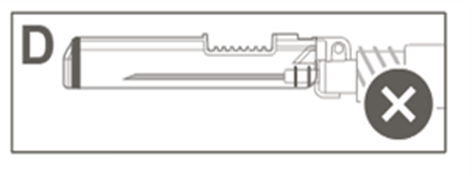
Vaihe 5: Tarkasta turvasuojuksen aktivoituminen silmämääräisesti. Turvasuojuksen on oltava täysin lukkiutunut (aktivoitunut), kuten kuvassa C on esitetty. Kuvassa D on turvasuojus, joka EI ole täysin lukkiutunut (ei ole aktivoitunut). | 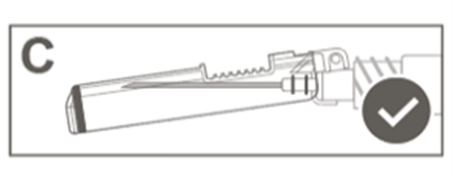
|
| Varoitus: Älä yritä poistaa turvalaitteen lukitusta (peruuttaa turvalaitteen aktivointia) ottamalla neula väkisin pois turvasuojuksesta. |
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.˃