ADZYNMA 500 IU injektiokuiva-aine ja liuotin, liuosta varten
ADZYNMA 1 500 IU injektiokuiva-aine ja liuotin, liuosta varten
rADAMTS13
Lisäseuranta
 Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Ks. kohdan Mahdolliset haittavaikutukset lopusta, miten haittavaikutuksista ilmoitetaan.
Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Ks. kohdan Mahdolliset haittavaikutukset lopusta, miten haittavaikutuksista ilmoitetaan.
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä ADZYNMA on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät ADZYNMA-valmistetta
3. Miten ADZYNMA-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. ADZYNMA-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
7. Käyttöohjeet
1. Mitä valmiste on ja mihin sitä käytetään
ADZYNMA-valmisteen vaikuttava aine on rADAMTS13, joka on luonnollisen ADAMTS13-entsyymin (proteiinin) keinotekoinen kopio. Tämä entsyymi puuttuu ihmisiltä, jotka sairastavat synnynnäistä tromboottista trombosytopeenistä purppuraa (cTTP).
Synnynnäinen TTP on hyvin harvinainen perinnöllinen verisairaus, jossa elimistön pieniin verisuoniin muodostuu verihyytymiä. Nämä verihyytymät voivat estää verenvirtausta ja hapen kuljetusta elimiin, mikä johtaa verihiutaleiden (veren hyytymiseen vaikuttavien ainesosien) normaalia pienempään määrään veressä.
Synnynnäinen TTP johtuu siitä, ettei veressä ole ADAMTS13-entsyymiä. ADAMTS13 ehkäisee verihyytymien muodostumista pilkkomalla von Willebrandin tekijäksi (VWF) kutsuttuja suuria molekyylejä. Liian suurikokoiset VWF-molekyylit voivat aiheuttaa vaarallisia verihyytymiä. ADZYNMA-valmistetta käytetään ADAMTS13-puutoksen korjaamiseen. Tällöin suuret molekyylit pilkkoutuvat pienemmiksi ja verihyytymien muodostumisen todennäköisyys pienenee, ja hoito saattaa myös ehkäistä alhaisia verihiutalearvoja cTTP-potilailla.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä ADZYNMA-valmistetta
- jos olet joskus saanut vaikean tai mahdollisesti henkeä uhkaavan allergisen reaktion rADAMTS13:sta tai tämän lääkkeen jostakin muusta aineesta (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät ADZYNMA-valmistetta.
Allergiset reaktiot
On olemassa riski, että ADZYNMA aiheuttaa sinulle allergistyyppisen yliherkkyysreaktion. Lääkärin on kerrottava sinulle vaikeiden allergisten reaktioiden varhaisista merkeistä, joita ovat esimerkiksi:
Jos sinulla ilmenee mitä tahansa näistä oireista, lääkäri päättää, onko ADZYNMA-hoito keskeytettävä, ja antaa sinulle asianmukaisia lääkkeitä allergisen reaktion hoitamiseksi. Voimakkaat oireet, kuten hengitysvaikeudet ja huimaus, vaativat nopeaa ensiapua.
Inhibiittorit
Neutraloivia vasta-aineita (joita kutsutaan inhibiittoreiksi) saattaa kehittyä joillekin ADZYNMA-valmistetta saaville potilaille. Nämä inhibiittorit voivat estää hoitoa tehoamasta oikein. Kerro lääkärille, jos sinusta tuntuu, että lääke on tehotonta.
Muut lääkevalmisteet ja ADZYNMA
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
ADZYNMA-valmistetta ei saa antaa raskauden aikana, paitsi jos lääkäri nimenomaisesti suosittelee sitä. Jos imetät, sinun ja lääkärin tulee päättää, voitko käyttää ADZYNMA-valmistetta.
Ajaminen ja koneiden käyttö
Tällä lääkkeellä voi olla vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. ADZYNMA-valmisteen käytön jälkeen voi esiintyä heitehuimausta ja uneliaisuutta (unisuutta).
Tietojen kirjaaminen
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on lääkkeen nimi ja eränumero dokumentoitava selkeästi.
ADZYNMA sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
ADZYNMA sisältää polysorbaatti 80:tä
Tämä lääkevalmiste sisältää 2,7 mg polysorbaatti 80:tä per ADZYNMA 500 IU:n tai 1500 IU:n injektiopullo, mikä vastaa enintään 0,216 mg:aa/kg. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
3. Miten valmistetta käytetään
ADZYNMA-hoito annetaan sellaisen lääkärin valvonnassa, jolla on kokemusta verisairauksien hoidosta.
ADZYNMA annetaan injektiona laskimoon. Se toimitetaan lääkärille kuiva-aineena, joka liuotetaan (saatetaan käyttökuntoon) mukana tulevalla liuottimella (nesteellä, johon kuiva-aine liukenee) ennen potilaalle antoa.
Annos lasketaan painon perusteella.
Lääkkeen ottaminen kotona
Lääkärin harkinnan mukaan voit ehkä käyttää ADZYNMA-valmistetta kotona, jos siedät injektiot hyvin. Kun pystyt pistämään ADZYNMA-valmisteen itse (tai omaishoitaja antaa sen sinulle) sen jälkeen, kun hoitava lääkäri ja/tai sairaanhoitaja on opettanut, miten se tapahtuu, lääkäri jatkaa hoitovasteesi seurantaa. Jos saat mitä tahansa haittavaikutuksia ottaessasi lääkettä kotona, injektio on lopetettava välittömästi ja sinun on otettava yhteyttä terveydenhuollon ammattilaiseen.
Suositeltu annos
Ennaltaehkäisevä entsyymikorvaushoito
Tavallinen annos on 40 IU painokiloa kohti joka toinen viikko.
Lääkäri saattaa muuttaa antotiheyttä kerran viikossa tapahtuvaksi, jos joka toinen viikko annettava ADZYNMA-hoito ei tehoa.
Tarvittaessa annettava äkillisten TTP-kohtausten entsyymikorvaushoito
Jos sinulle kehittyy äkillinen tromboottisen trombosytopeenisen purppuran (TTP) kohtaus, suositeltu ADZYNMA-annos on:
Jos otat enemmän ADZYNMA-valmistetta kuin sinun pitäisi
Liian suuren lääkeannoksen ottaminen voi aiheuttaa verenvuotoa.
Jos unohdat käyttää ADZYNMA-valmistetta
Jos sinulta on jäänyt ADZYNMA-injektio väliin, kerro siitä lääkärille mahdollisimman pian. Älä ota kaksinkertaista annosta korvataksesi unohtamasi kerta-annoksen.
Jos lopetat ADZYNMA-valmisteen käytön
Keskustele lääkärin kanssa, jos haluat lopettaa ADZYNMA-hoidon. Sairautesi oireet voivat pahentua, jos lopetat hoidon.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on raportoitu ADZYNMA-hoidon yhteydessä:
Hyvin yleiset (voi esiintyä useammalla kuin 1 henkilöllä 10:stä)
- nenän ja nielun infektio
- päänsärky
- huimaus
- migreeni
- ripuli
- pahoinvointi
Yleiset (voi esiintyä enintään 1 henkilöllä 10:stä)
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä etiketissä ja kotelossa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Avaamattomat injektiopullot
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
ADZYNMA-kuiva-ainetta sisältäviä avaamattomia injektiopulloja saa säilyttää huoneenlämmössä (enintään 30 °C:ssa) enintään 6 kuukauden ajan, mutta ei kuitenkaan viimeistä käyttöpäivämäärää pidempään. Älä palauta huoneenlämmössä säilytettyä ADZYNMA-valmistetta jääkaappiin. Merkitse ADZYNMA-valmisteen koteloon päivä, jolloin valmiste poistettiin jääkaapista.
Käyttökuntoon saattamisen jälkeen
Käyttökuntoon saatettu käyttämätön valmiste on hävitettävä 3 tunnin kuluttua.
Älä käytä tätä lääkettä, jos huomaat, että se ei ole kirkasta ja väritöntä.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä ADZYNMA sisältää
- Vaikuttava aine, rADAMTS13, on ihmisen puhdistettu rekombinantti ”disintegriini ja metalloproteinaasi, jossa on trombospondiini 13 -rakennekuvioita”.
- Yksi kuiva-ainetta sisältävä injektiopullo sisältää nimellisesti 500 tai 1 500 IU rADAMTS13-aktiivisuutta.
- Liuotininjektiopullo sisältää 5 ml injektionesteisiin käytettävää vettä.
- Muut apuaineet ovat natriumkloridi, kalsiumklorididihydraatti, L-histidiini, mannitoli, sakkaroosi ja polysorbaatti 80 (E433). Ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”ADZYNMA sisältää natriumia” ja ”ADZYNMA sisältää polysorbaatti 80:tä”.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
ADZYNMA toimitetaan injektiokuiva-aineena ja liuottimena, liuosta varten. Kuiva-aine on valkoinen, kylmäkuivattu jauhe. Liuotin on kirkasta ja väritöntä.
Yksi pakkaus sisältää yhden kuiva-ainetta sisältävän injektiopullon, yhden liuotinta sisältävän injektiopullon, laitteen valmisteen käyttökuntoon saattamista varten (BAXJECT II Hi-Flow), kertakäyttöruiskun, yhden infuusiosetin ja kaksi alkoholipyyhettä.
Myyntiluvan haltija ja valmistaja
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Itävalta
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Takeda Oy
Puh/Tel: 0800 774 051
medinfoEMEA@takeda.com
Tämä pakkausseloste on tarkistettu viimeksi 08/2024.
Tämän lääkevalmisteen myyntilupa on myönnetty poikkeuksellisin perustein. Se tarkoittaa, että lääkevalmisteesta ei ole ollut mahdollista saada täydellisiä tietoja sairauden harvinaisuuden vuoksi. Euroopan lääkevirasto arvioi vuosittain uudet tiedot tästä lääkkeestä, ja tarvittaessa tämä pakkausseloste päivitetään.
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu . Siellä on myös linkkejä muille harvinaisia sairauksia ja niiden hoitoja käsitteleville verkkosivuille.
Ohjeet terveydenhuollon ammattilaiselle
Näissä käyttöohjeissa on tietoa ADZYNMA-valmisteen käyttökuntoon saattamisesta ja infusoinnista.
Nämä käyttöohjeet on tarkoitettu terveydenhuollon ammattilaisille ja potilaille / omaishoitajille, jotka antavat ADZYNMA-valmistetta kotona terveydenhuollon ammattilaisen antaman asianmukaisen opastuksen jälkeen.
ADZYNMA-hoidon määrää ja sitä valvoo terveydenhuollon ammattilainen, jolla on kokemusta verisairauksien hoidosta.
Tärkeää:
Käyttökuntoon saattaminen
1. Valmistele puhdas ja tasainen työtaso ja kerää kaikki tarvikkeet, joita tarvitset valmisteen käyttökuntoon saattamiseen ja antoon (kuva A). |
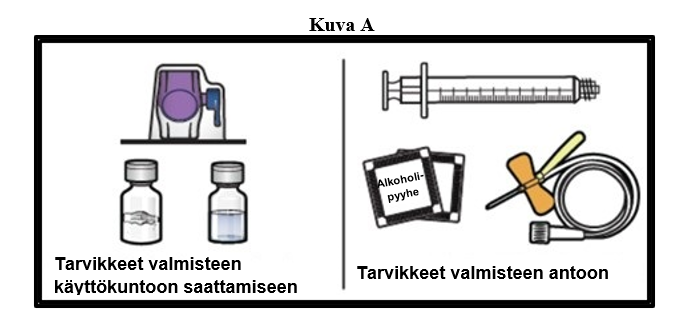
|
2. Anna ADZYNMA-injektiopullojen ja laimentimen lämmetä huoneenlämpöisiksi ennen käyttöä.
3. Pese ja kuivaa kädet huolellisesti.
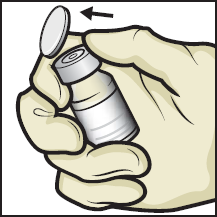
4. Poista ADZYNMA-valmistetta ja laimenninta sisältävien injektiopullojen muovikorkit ja aseta injektiopullot tasaiselle alustalle (kuva B).
Kuva B
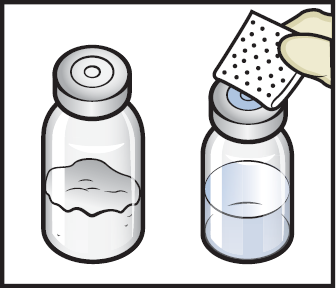
5. Pyyhi kumitulpat alkoholipyyhkeellä ja anna niiden kuivua ennen käyttöä. (kuva C).
Kuva C
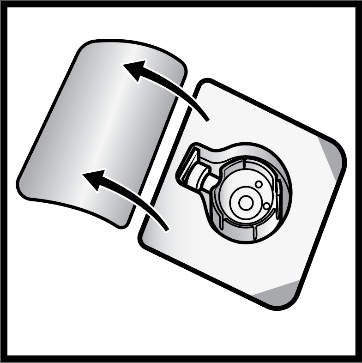
6. Avaa BAXJECT II Hi‑Flow -laitteen pakkaus vetämällä kansi irti sisältöön koskematta (kuva D).
Kuva D
7. Käännä BAXJECT II Hi-Flow -laitteen pakkaus ylösalaisin ja aseta se laimenninta sisältävän injektiopullon päälle. Paina suoraan alaspäin, kunnes kirkas muovipiikki lävistää laimenninta sisältävän injektiopullon tulpan (kuva E).
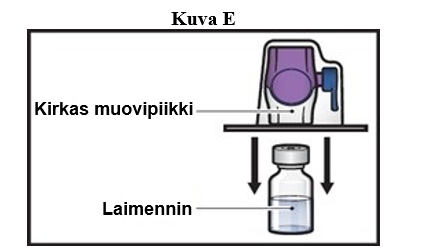
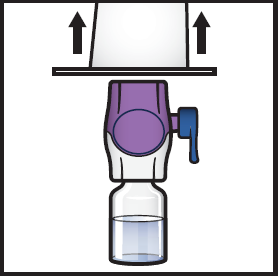
8. Tartu BAXJECT II Hi-Flow -laitteen pakkauksen reunaan ja vedä pakkaus pois laitteen päältä (kuva F).
- Älä poista BAXJECT II Hi‑Flow -laitteen sinistä korkkia.
- Älä koske paljastuneeseen violettiin muovipiikkiin.
Kuva F
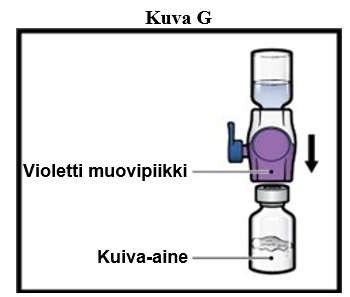
9. Käännä järjestelmä ympäri niin, että laimenninta sisältävä injektiopullo on ylimpänä. Paina BAXJECT II Hi‑Flow -laitetta suoraan alaspäin, kunnes violetti muovipiikki lävistää ADZYNMA-kuiva-ainetta sisältävän injektiopullon tulpan (kuva G). Tyhjiö imee laimentimen ADZYNMA-kuiva-ainetta sisältävään injektiopulloon.
- Saatat huomata hieman ilmakuplia tai vaahtoa – se on normaalia, ja niiden pitäisi hävitä nopeasti.
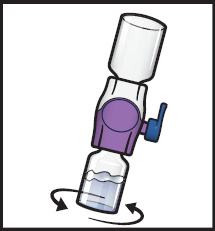
10. Pyörittele yhdistettyjä injektiopulloja varovasti ja tauotta, kunnes kuiva-aine on liuennut täysin (kuva H).
Kuva H
11. Tarkista käyttökuntoon saatettu liuos silmämääräisesti hiukkasten varalta ennen antoa.
- Älä käytä valmistetta, jos siinä on näkyviä hiukkasia tai värimuutoksia.
12. Jos annokseen tarvitaan useampia ADZYNMA-injektiopulloja, saata kukin injektiopullo käyttökuntoon yllä olevia vaiheita noudattaen.
ADZYNMA-valmisteen anto
13. Poista BAXJECT II Hi-Flow -laitteen sininen korkki (kuva I). Kiinnitä luer‑lock -ruisku (kuva J).
| Kuva I | Kuva J | 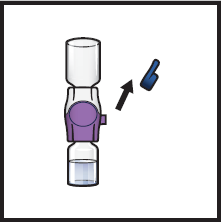 | 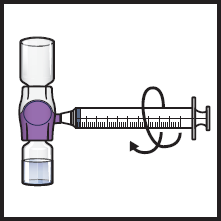 |
|
14. Käännä järjestelmä ylösalaisin (ADZYNMA-injektiopullo on nyt ylimpänä). Vedä käyttökuntoon saatettu liuos ruiskuun vetämällä mäntää hitaasti (kuva K).
Kuva K
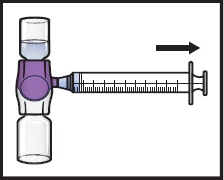
15. Jos potilaan annokseen tarvitaan useampia ADZYNMA-injektiopulloja, useampien injektiopullojen sisällön saa vetää samaan ruiskuun. Toista mainitut vaiheet kaikkien käyttökuntoon saatettujen ADZYNMA-injektiopullojen osalta, kunnes potilaalle annettava kokonaistilavuus saavutetaan.
16. Irrota ruisku ja kiinnitä siihen sopiva injektioneula tai infuusiosetti.
17. Käännä neulan kärki ylöspäin ja poista ilmakuplat naputtelemalla ruiskua varovasti sormella ja työntämällä ilma ruiskusta ja neulasta hitaasti ja varovasti.
18. Aseta kiristysside paikoilleen ja puhdista valitsemasi pistoskohta alkoholipyyhkeellä (kuva L).
Kuva L
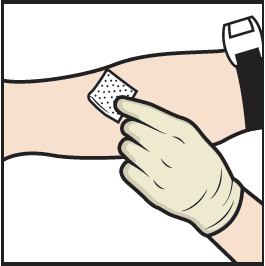
19. Vie neula suoneen ja poista kiristysside.
20. Anna käyttökuntoon saatettu ADZYNMA hitaana infuusiona nopeudella 2–4 ml minuutissa (kuva M).
Kuva M
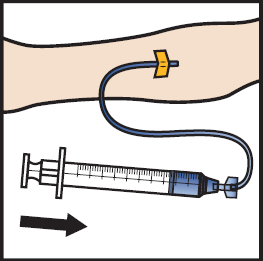
21. Vedä neula pois suonesta ja paina pistoskohtaa useiden minuuttien ajan.
ADZYNMA-valmisteen säilyttäminen
- Säilytä ADZYNMA-valmistetta kylmässä (2 °C – 8 °C) tai huoneenlämmössä (enintään 30 °C) enintään 6 kuukauden ajan.
- Älä palauta huoneenlämmössä säilytettyä ADZYNMA-valmistetta jääkaappiin.
- Merkitse ADZYNMA-valmisteen koteloon päivä, jolloin valmiste poistettiin jääkaapista.
- Ei saa jäätyä.
- Säilytä alkuperäispakkauksessa. Herkkä valolle.
- Älä käytä etiketissä ja kotelossa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen.
- Käytä ADZYNMA 3 tunnin kuluessa käyttökuntoon saattamisesta. Hävitä käyttökuntoon saatettu käyttämätön valmiste, jos sitä ei käytetä 3 tunnin kuluessa käyttökuntoon saattamisesta.
ADZYNMA-valmisteen hävittäminen
- Injektiopullot ovat kertakäyttöisiä.
- Hävitä neula, ruisku ja tyhjät injektiopullot pistonkestävään terävän jätteen säiliöön.
- Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.