Herceptin 150 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
trastutsumabi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Herceptin on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Herceptiniä
- Miten Herceptiniä annetaan
- Mahdolliset haittavaikutukset
- Herceptinin säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Herceptinin vaikuttavana aineena on trastutsumabi, joka on monoklonaalinen vasta-aine. Monoklonaaliset vasta-aineet sitoutuvat tiettyyn proteiiniin tai antigeeniin. Trastutsumabi on tarkoitettu sitoutumaan valikoivasti antigeeniin, jota kutsutaan ihmisen epidermaalisen kasvutekijän reseptori 2:ksi (HER2). HER2:ta esiintyy suurina määrinä tiettyjen syöpäsolujen pinnalla, joissa se kiihdyttää näiden kasvua. Herceptinin sitoutuminen HER2:een pysäyttää kyseisten syöpäsolujen kasvun, mistä on seurauksena syöpäsolun kuolema.
Lääkäri saattaa määrätä Herceptiniä hoidoksi rintasyöpään tai mahasyöpään, jos
- sinulla on varhaisvaiheen rintasyöpä, joka tuottaa suuria määriä HER2-nimistä proteiinia.
- sinulla on etäpesäkkeinen rintasyöpä (toisin sanoen rintasyöpä on levinnyt muualle elimistöön alkuperäisestä kasvaimesta), ja syöpäkasvaimet tuottavat suuria määriä HER2:ta. Herceptiniä käytetään ensimmäisenä hoitona yhdistettynä solunsalpaajiin, paklitakseliin tai doketakseliin, etäpesäkkeisessä rintasyövässä. Valmistetta käytetään myös yksinään tilanteissa, joissa muu hoito ei ole ollut tehokasta. Sitä käytetään myös yhdessä aromataasinestäjien kanssa potilailla, joilla on HER2-positiivinen ja hormonireseptoripositiivinen levinnyt rintasyöpä (kasvain on herkkä naisen sukupuolihormoneille).
- sinulla on etäpesäkkeinen mahasyöpä, joka tuottaa suuria määriä HER2:ta. Herceptiniä käytetään yhdessä muiden syöpälääkkeiden, kapesitabiinin tai 5-fluorourasiilin ja sisplatiinin kanssa
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Herceptiniä
- jos olet allerginen (yliherkkä) trastutsumabille, hiiren proteiineille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on vakavia syövästäsi johtuvia hengitysvaikeuksia levossa tai jos tarvitset lisähappea.
Varoitukset ja varotoimet
Lääkäri tulee seuraamaan hoitoasi tarkoin.
Sydämen toiminnan seuranta
Herceptin-hoito yksinään tai yhdistettynä taksaaniin saattaa vaikuttaa sydämeen, erityisesti jos olet käyttänyt aiemmin antrasykliinejä (taksaanit ja antrasykliinit ovat muita syöpälääkkeitä). Vaikutukset saattavat olla kohtalaisia tai vaikeita ja saattavat johtaa kuolemaan. Tämän vuoksi sydämen toiminta tutkitaan ennen Herceptin-hoidon aloittamista ja sitä seurataan hoidon aikana (joka kolmas kuukausi) ja seurantaa jatketaan Herceptin-hoidon lopettamisen jälkeen (kahdesta viiteen vuoteen).
Jos sinulle kehittyy sydämen vajaatoiminnan oireita (eli sydän ei pumppaa riittävästi verta), sydämesi toiminta saatetaan tutkia tiheämmin (kuudesta kahdeksaan viikon välein) ja saatat saada hoitoa sydämen vajaatoimintaan tai Herceptin-hoito saattaa olla tarpeen lopettaa.
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle ennen kuin sinulle annetaan Herceptiniä:
- jos sinulla on ollut sydämen vajaatoimintaa, sepelvaltimotauti, sydämen läppävika (sydämen sivuäänet), korkea verenpaine tai jos olet joskus käyttänyt verenpainelääkkeitä tai parhaillaan käytät jotakin verenpainelääkettä.
- jos olet koskaan aiemmin saanut tai parhaillaan käytät doksorubisiinia tai epirubisiinia sisältävää lääkettä (syöpälääkkeitä). Nämä lääkeaineet (tai muut antrasykliinit) voivat vahingoittaa sydänlihasta ja lisätä sydänongelmien riskiä Herceptin-hoidon aikana.
- jos sinulla on aiemmin ollut tai sinulla on hengitystoiminnan vajetta (hengästyneisyyttä), etenkin jos parhaillaan käytät jotakin taksaania. Herceptin saattaa aiheuttaa hengitysvaikeuksia erityisesti ensimmäisellä antokerralla. Oireet saattavat olla vakavampia, jos sinulla esiintyy valmiiksi hengitystoiminnan vajetta. Hyvin harvoissa tapauksissa potilaat, joilla on ollut vaikeita hengitysvaikeuksia jo ennen hoidon aloittamista, ovat kuolleet annettaessa Herceptiniä.
- jos sinulle on aiemmin annettu muita syöpähoitoja
Jos sinulle annetaan Herceptiniä yhdessä minkä tahansa syöpälääkkeen, kuten paklitakselin, dosetakselin, aromataasin estäjän, kapesitabiinin, 5-fluorourasiilin tai sisplatiinin kanssa, sinun tulee lukea myös näiden valmisteiden pakkausselosteet.
Lapset ja nuoret
Herceptiniä ei suositella alle 18-vuotiaille.
Muut lääkevalmisteet ja Herceptin
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Herceptinin poistuminen elimistöstä saattaa kestää jopa 7 kuukautta. Tämän vuoksi sinun pitää kertoa lääkärille tai apteekkihenkilökunnalle saaneesi Herceptiniä, jos aloitat minkä tahansa uuden lääkkeen käytön 7 kuukauden sisällä hoidon lopettamisesta
Raskaus
- Jos olet raskaana, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä, apteekkihenkilökunnalta tai sairaanhoitajalta neuvoa ennen tämän lääkkeen käyttöä.
- Sinun on käytettävä tehokasta ehkäisyä Herceptin-hoidon aikana ja ainakin 7 kuukauden ajan viimeisen annoksen jälkeen.
- Lääkäri neuvoo sinua lääkkeen mahdollisista raskaudenaikaisista hyödyistä ja haitoista. Harvinaisissa tapauksissa lapsiveden (ympäröi kehittyvää lasta kohdussa) niukkuutta on havaittu Herceptiniä saavilla, raskaana olevilla naisilla. Lapsiveden vähyys saattaa olla haitallinen sikiölle, ja se on yhdistetty heikentyneeseen keuhkojen kehittymiseen sikiökuolemissa.
Imetys
Älä imetä lasta Herceptin-hoidon aikana äläkä 7 kuukauden kuluessa hoidon lopettamisesta, koska lapsi saattaa saada Herceptin-valmistetta rintamaidon välityksellä.
Kysy lääkäriltä tai apteekista neuvoa ennen minkään lääkkeen käyttöä raskauden ja imetyksen aikana.
Ajaminen ja koneiden käyttö
Herceptin saattaa vaikuttaa kykyysi ajaa autoa tai käyttää koneita. Jos sinulla ilmenee Herceptin-hoidon aikana oireita, kuten huimausta, uneliaisuutta, vilunväristyksiä tai kuumetta, sinun ei pidä ajaa autoa eikä käyttää koneita, ennen kuin oireet ovat lakanneet.
3. Miten valmistetta käytetään
Ennen hoidon aloittamista lääkäri määrittää HER2:n määrän kasvaimestasi. Herceptinillä hoidetaan vain potilaat, joiden kasvain tuottaa runsaasti HER2:ta. Herceptinin saa antaa vain lääkäri tai sairaanhoitaja. Lääkärisi tulee määräämään sinulle sopivan annoksen ja hoito-ohjelman. Herceptin-annos määräytyy painosi mukaan.
Herceptinistä on olemassa kaksi lääkemuotoa:
- toinen annetaan infuusiona laskimoon ja
- toinen annetaan injektiona ihon alle
On tärkeää tarkistaa valmisteen etiketistä, että potilaalle annetaan oikeaa, lääkemääräyksen mukaista (laskimoon annettavaa tai ihon alle annettavaa) lääkemuotoa. Laskimoon annettavaa Herceptin-valmistetta ei ole tarkoitettu annettavaksi ihon alle, joten sitä saa antaa vain injektiona laskimoon.
Lääkäri saattaa vaihtaa laskimoon annettavan Herceptin-hoidon ihon alle annettavaan Herceptin-hoitoon (tai päinvastoin), jos se katsotaan sinulle tarkoituksenmukaiseksi.
Herceptinin laskimonsisäinen lääkemuoto annetaan laskimonsisäisenä infuusiona (tiputuksena). Ensimmäinen infuusio kestää 90 minuuttia. Terveydenhoidon ammattilaiset seuraavat vointiasi tarkoin infuusion ajan mahdollisten haittavaikutusten vuoksi. Jos siedät ensimmäisen annoksen hyvin, seuraavat infuusiot voidaan mahdollisesti antaa 30 minuutissa (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, Varoitukset ja varotoimet). Saamiesi infuusioiden lukumäärä riippuu siitä, kuinka hoito vaikuttaa sinuun (hoitovasteestasi). Lääkärisi keskustelee kanssasi tästä.
Lääkitysvirheiden välttämiseksi on tärkeää varmistaa injektiopullon etiketistä, että valmistettava ja annettava lääkevalmiste on Herceptin (trastutsumabi) eikä toinen trastutsumabia sisältävä valmiste (esim. trastutsumabiemtansiini tai trastutsumabi-derukstekaani).
Varhaisen vaiheen rintasyövässä, metastasoituneessa rintasyövässä ja metastasoituneessa mahasyövässä Herceptiniä annetaan 3 viikon välein. Herceptiniä saatetaan antaa myös kerran viikossa metastasoituneessa rintasyövässä.
Jos lopetat Herceptinin käytön
Älä lopeta tämän lääkkeen käyttöä keskustelematta ensin lääkärin kanssa. Kaikki annokset on otettava oikeana ajankohtana viikon tai kolmen viikon välein (sinulle määrätyn annostuksen mukaisesti). Näin lääke vaikuttaa parhaalla mahdollisella tavalla.
Herceptinin poistuminen elimistöstä saattaa kestää 7 kuukautta. Lääkäri saattaa siksi jatkaa sydämesi toiminnan seurantaa vielä hoidon pääättymisen jälkeen.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, Herceptinkin voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Jotkin niistä voivat olla vakavia ja vaatia sairaalahoitoa.
Herceptin-infuusion aikana voi esiintyä vilunväristyksiä, kuumetta tai muita flunssan tapaisia oireita. Nämä haittavaikutukset ovat hyvin yleisiä (mahdollisesti yli kymmenellä potilaalla sadasta). Muita infuusioon liittyviä oireita ovat pahoinvointi, oksentelu, kipu, lisääntynyt lihasjänteys ja tärinä, päänsärky, huimaus, hengitysvaikeudet, verenpaineen nousu tai lasku, sydämen rytmihäiriöt (tykytykset, sydämen läpätys tai epäsäännöllinen sydämen syke), kasvojen ja huulten turvotus, ihottuma ja väsymys. Osa näistä oireista voi olla vakavia, ja ne ovat joskus johtaneet potilaan kuolemaan (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, Varoitukset ja varotoimet).
Näitä oireita ilmenee pääasiallisesti ensimmäisen laskimoon annetun infuusion (tiputus laskimoon) yhteydessä ja muutaman tunnin aikana infuusion aloittamisesta. Oireet ovat yleensä ohimeneviä. Terveydenhoidon ammattilainen seuraa vointiasi infuusioiden ajan sekä 6 tunnin ajan ensimmäisen infuusion aloittamisesta ja 2 tunnin ajan seuraavien infuusioiden aloittamisesta. Jos sinulle tulee edellä mainitun kaltainen reaktio, infuusionopeutta hidastetaan tai infuusio keskeytetään kokonaan ja sinulle saatetaan antaa hoitoa haittavaikutuksiin. Infuusiota voidaan jatkaa oireiden mentyä ohi.
Satunnaisesti oireet voivat alkaa kuusi tuntia infuusion aloittamisen jälkeen. Jos havaitset edellä mainittuja oireita, ota välittömästi yhteyttä lääkäriin. Joskus oireet saattavat lievittyä mutta voivat pahentua myöhemmin.
Vakavat haittavaikutukset
Muita haittavaikutuksia voi esiintyä milloin tahansa Herceptin-hoidon aikana eikä vain infuusion antoon liittyvinä. Jos havaitset jonkin seuraavista haittavaikutuksista, kerro siitä heti lääkärille tai sairaanhoitajalle:
- Sydänongelmia saattaa esiintyä hoidon aikana tai satunnaisesti hoidon loppumisen jälkeen, ja ne voivat olla vakavia. Näihin kuuluvat sydänlihaksen toiminnan heikkeneminen, joka saattaa johtaa sydämen vajaatoimintaan, sydäntä ympäröivän pussin tulehdus ja sydämen rytmihäiriöt. Nämä saattavat ilmetä mm. seuraavina oireina: hengitysvaikeudet (myös yöllisiä), yskä, nesteen kertyminen jalkoihin tai käsivarsiin (turvotus), sydämentykytys (sydämen läpätys tai epäsäännöllinen sydämen syke) (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä Sydämen toiminnan seuranta).
Lääkäri tarkkailee sydäntäsi säännöllisesti hoidon aikana ja hoidon jälkeen, mutta sinun tulee kertoa välittömästi, jos huomaat jokin edellä mainituista oireista.
- Tuumorilyysioireyhtymä (ryhmä syöpähoidon jälkeen ilmeneviä aineenvaihduntaan liittyviä lisätauteja, joille tyypillisiä ovat suuret kalium- ja fosfaattipitoisuudet veressä sekä pieni kalsiumpitoisuus veressä). Oireita voivat olla munuaisvaivat (heikotus, hengenahdistus, uupumus ja sekavuus), sydänvaivat (sydämen läpätys tai tavanomaista nopeampi tai hitaampi sydämen syke), kouristukset, oksentelu tai ripuli ja kihelmöinti suussa, käsissä tai jalkaterissä.
Jos sinulla ilmenee jokin yllä mainituista oireista Herceptin-hoidon päättymisen jälkeen, ota yhteyttä lääkäreihin ja kerro heille Herceptin-hoidostasi.
Hyvin yleisiä Herceptinin aiheuttamia haittavaikutuksia, joita esiintyy yli 1 potilaalla kymmenestä, ovat
- infektiot
- ripuli
- ummetus
- närästys
- uupumus
- ihottumat
- rintakipu
- vatsakipu
- nivelkipu
- punasolujen ja valkosolujen määrän vähentyminen (valkosolut ovat soluja, jotka auttavat elimistöä puolustautumaan tulehdusta vastaan), johon voi joskus liittyä kuumetta
- lihaskipu
- sidekalvotulehdus
- liiallinen kyynelnesteen eritys
- nenäverenvuodot
- vuotava nenä
- hiustenlähtö
- vapina
- kuumat aallot
- huimaus
- kynsimuutokset
- painon lasku
- ruokahaluttomuus
- unettomuus (insomnia)
- makuhäiriö
- alhainen verihiutalemäärä
- mustelmat
- sormien ja varpaiden puutuminen tai pistely
- suun ja/tai nielun punoitus, turpoaminen tai haavaumat
- käsien ja/tai jalkaterien kipu, turpoaminen, punoitus tai pistely
- hengästyneisyys
- päänsärky
- yskä
- oksentelu
- pahoinvointi.
Yleisiä Herceptinin aiheuttamia haittavaikutuksia, joita esiintyy yli 1 potilaalla sadasta, ovat
- allergiset reaktiot
- kurkkuinfektiot
- rakon ja ihon tulehdukset
- rintatulehdus
- maksatulehdus
- munuaisten toimintahäiriö
- lisääntynyt lihasjännitys (hypertonia)
- käsivarsien ja jalkojen kipu
- ihottuma (kutiseva)
- uneliaisuus (somnolenssi)
- peräpukamat
- kutina
- suun ja ihon kuivuminen
- silmien kuivuus
- hikoilu
- heikkouden tunne ja huonovointisuus
- ahdistuneisuus
- masentuneisuus
- astma
- keuhkoinfektio
- keuhkojen toimintahäiriöt
- selkäkipu
- niskakipu
- luukipu
- akne
- jalkakrampit
Melko harvinaiset Herceptinin haittavaikutukset (esiintyy alle 1 potilaalla sadasta):
- kuurous
- ihottuma (näppyläinen)
- hengityksen vinkuminen
- keuhkojen tulehdus tai arpeutuminen.
Harvinaiset Herceptinin haittavaikutukset (esiintyy alle 1 potilaalla tuhannesta)
- keltaisuus
- anafylaktinen reaktio.
Muut haittavaikutukset, joita on raportoitu Herceptinin käytön yhteydessä (saatavilla oleva tieto ei riitä yleisyyden arviointiin):
- poikkeavuudet veren hyytymisessä tai heikentynyt veren hyytyminen
- korkea kaliumpitoisuus
- silmäntakainen turvotus tai verenvuoto
- sokki
- sydämenlyönnin epäsäännöllisyys
- hengitysvaikeudet
- hengitysvajaus
- akuutti nesteenkertyminen keuhkoihin
- akuutti hengitystieahtauma
- normaalia alhaisempi happipitoisuus veressä
- hengitysvaikeudet makuulla
- maksavaurio
- kasvojen, huulien ja nielun turvotus
- munuaisten vajaatoiminta
- normaalia vähäisempi lapsiveden määrä (ympäröi kehittyvää lasta kohdussa)
- lapsen keuhkojen vajaakehitys kohdussa
- poikkeavuudet kohdussa tapahtuvassa lapsen munuaisten kehittymisessä.
Osa kokemistasi haittavaikutuksista saattaa liittyä sairauteesi eli syöpään. Jos saat Herceptiniä yhdessä solunsalpaajahoidon kanssa, osa oireista saattaa liittyä myös solunsalpaajahoitoon.
Jos havaitset haittavaikutuksia, kerro niistä lääkärillesi tai apteekkihenkilökunnalle tai sairaanhoitajallesi.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Terveydenhuollon ammattilaiset säilyttävät Herceptin-valmisteen sairaalassa tai klinikalla.
- Ei lasten ulottuville eikä näkyville.
- Älä käytä ulkopakkauksessa äläkä injektiopullon etiketissä mainitun viimeisen käyttöpäivämäärän jälkeen (Käyt. viim./EXP). Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä avaamaton injektiopullo jääkaapissa (2 °C – 8 °C).
- Välikonsentraatti ei saa jäätyä.
- Infuusioliuokset on käytettävä heti laimentamisen jälkeen. Jos liuosta ei käytetä heti, käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla eivätkä saa tavallisesti ylittää 24 tuntia 2–8 °C:ssa.
- Älä käytä Herceptiniä, jos huomaat näkyviä muutoksia lääkevalmisteen ulkonäössä (hiukkasia tai värimuutoksia) ennen annostelua.
- Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Herceptin sisältää
- Vaikuttava aine on trastutsumabi. Jokainen Herceptin-injektiopullo sisältää 150 mg trastutsumabia, joka liuotetaan 7,2 ml:aan injektionesteisiin käytettävää vettä. Saatu liuos sisältää trastutsumabia noin 21 mg/ml
- Muut aineet ovat L-histidiinihydrokloridimonohydraatti, L-histidiini, α,α-trehaloosidihydraatti ja polysorbaatti 20.
Lääkevalmisteen kuvaus ja pakkauskoko
Herceptin infuusiokuiva-aine konsentraattiliuosta varten, on kumitulpallisessa lasisessa injektiopullossa, jossa on 150 mg trastutsumabia. Aine on valkoista tai vaaleankeltaista kylmäkuivattua jauhetta. Jokainen pakkaus sisältää yhden injektiopullon.
Myyntiluvan haltija
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Saksa
Valmistaja
Roche Pharma AG Emil-Barell-Strasse 1 79639 Grenzach-Wyhlen
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja.
België/Belgique/Belgien N.V. Roche S.A. Tél/Tel: +32 (0) 2 525 82 11 | Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
България Рош България ЕООД Тел: +359 2 818 44 44 | Luxembourg/Luxemburg (Voir/siehe Belgique/Belgien) |
Česká republika Roche s. r. o. Tel: +420 - 2 20382111 | Magyarország Roche (Magyarország) Kft. Tel: +36 – 1 279 4500 |
Danmark Roche Pharmaceuticals A/S Tlf: +45 - 36 39 99 99 | Malta (See Ireland) |
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 | Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Eesti Roche Eesti OÜ Tel: + 372 - 6 177 380 | Norge Roche Norge AS Tlf: +47 - 22 78 90 00 |
Ελλάδα Roche (Hellas) A.E. Τηλ: +30 210 61 66 100 | Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
España Roche Farma S.A. Tel: +34 - 91 324 81 00 | Polska Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88 |
France Roche Tél: +33 (0) 1 47 61 40 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 - 21 425 70 00 |
Hrvatska Roche d.o.o. Tel: + 385 1 47 22 333 | România Roche România S.R.L. Tel: +40 21 206 47 01 |
Ireland Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700 | Slovenija Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00 |
Ísland Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
Italia Roche S.p.A. Tel: +39 - 039 2471 | Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
Kύπρος Γ.Α.Σταμάτης & Σια Λτδ. Τηλ: +357 - 22 76 62 76 | Sverige Roche AB Tel: +46 (0) 8 726 1200 |
Latvija Roche Latvija SIA Tel: +371 - 6 7 039831 | United Kingdom (Northern Ireland) Roche Products (Ireland) Ltd. Tel: +44 (0) 1707 366000 |
Tämä pakkausseloste on tarkistettu viimeksi maaliskuussa 2023
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta http://www.ema.europa.eu/ .
Tämä pakkausseloste on saatavissa kaikilla EU-kielillä Euroopan lääkeviraston verkkosivustolla.
Ohjeet terveydenhuollon ammattilaiselle
Laskimoon annettava Herceptin on steriilissä, pyrogeenittomassa, kertakäyttöisessä injektiopullossa, joka ei sisällä säilytysainetta.
Tämä lääke on aina säilytettävä suljetussa alkuperäispakkauksessaan jääkaapissa, 2 °C - 8°C:n lämpötilassa.
Liuottamisessa ja laimentamisessa on käytettävä soveltuvaa aseptista tekniikkaa. Valmistettavien liuosten steriiliys on varmistettava huolellisesti. Tämä lääkevalmiste ei sisällä antimikrobista säilytysainetta eikä bakteriostaattisia aineita, joten sitä on käsiteltävä aseptisesti.
Herceptin-injektiopullo, jonka sisältö on liuotettu aseptisesti steriiliin, injektionesteisiin käytettävään veteen (ei sisälly pakkaukseen), säilyy fysikaalisesti ja kemiallisesti stabiilina 48 tuntia 2 °C – 8 °C:ssa. Liuos ei saa jäätyä.
9 mg/ml (0,9 %) natriumkloridiliuosta sisältäviin polyvinyylikloridi-, polyeteeni- tai polypropeenipusseihin aseptisesti laimennetun Herceptin-infuusioliuoksen on osoitettu säilyvän fysikaalisesti ja kemiallisesti stabiilina 30 vuorokautta 2 °C – 8 °C:ssa, ja 24 tuntia enintään 30 °C:ssa.
Mikrobiologiselta kannalta katsottuna liuotettu infuusiokuiva-aine ja valmis Herceptin-infuusioliuos tulisi käyttää heti. Mikäli liuotettua ja/tai laimennettua Herceptiniä ei käytetä heti, säilytysajat ja ˗olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä saa tavallisesti ylittää 24 tuntia 2 °C – 8 °C:ssa, paitsi jos valmiste on liuotettu ja laimennettu kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Aseptinen käyttökuntoon saattaminen, käsittely ja säilytys:
Infuusion käyttökuntoon saattamisessa on noudatettava aseptista toimintatapaa.
- Käyttökuntoon saattaminen on tehtävä aseptisissa olosuhteissa. Koulutettu henkilökunta saattaa infuusioliuoksen käyttökuntoon hyvien toimintatapojen mukaisesti, etenkin parenteraalisesti annettavien valmisteiden aseptista käsittelyä koskevien ohjeiden mukaisesti.
- Käyttökuntoon saattaminen on tehtävä laminaarivirtauskaapissa tai biologisessa suojakaapissa laskimoon annettavien lääkeaineiden turvallista käsittelyä koskevien tavanomaisten varotoimien mukaisesti.
- Käyttökuntoon saatettua laskimoon annettavaa infuusioliuosta säilytetään asianmukaisesti, jotta varmistetaan aseptisten olosuhteiden säilyminen.
Jokaisen Herceptin-injektiopullon sisältö liuotetaan 7,2 ml:aan injektionesteisiin käytettävää vettä (ei sisälly pakkaukseen). Kuiva-aineen liuottamiseen ei pidä käyttää muita liuoksia. Näin saadaan 7,4 ml kerta-annokseen soveltuvaa konsentraattia, joka sisältää trastutsumabia noin 21 mg/ml. Neljän prosentin tilavuusylimäärä varmistaa sen, että ilmoitettu 150 mg:n annos saadaan vedettyä jokaisesta injektiopullosta.
Herceptiniä on käsiteltävä varoen sen liuottamisen ja laimentamisen yhteydessä. Liiallinen vaahtoaminen liuottamisen yhteydessä tai liuenneen Herceptinin ravistelu voi aiheuttaa ongelmia riittävän määrän vetämisessä injektiopullosta.
Ohjeet aseptiseen liuottamiseen:
1) Käytä steriiliä ruiskua ja injisoi hitaasti 7,2 ml injektionesteisiin käytettävää vettä kylmäkuivattua Herceptin-jauhetta sisältävään injektiopulloon. Suuntaa vesisuihku kylmäkuivattuun jauhekakkuun.
2) Pyöritä injektiopulloa varovasti liukenemisen edistämiseksi. ÄLÄ RAVISTELE!
Pieni vaahtoaminen liuottamisen yhteydessä ei ole harvinaista. Anna injektiopullon seistä rauhassa noin viisi minuuttia. Aikaansaatu infuusiokonsentraatti on väritön tai vaaleankeltainen, läpinäkyvä liuos, jonka tulisi olla käytännöllisesti katsoen hiukkasetonta.
Ohjeet välikonsentraatin aseptiseen laimentamiseen
Tarvittava konsentraattitilavuus lasketaan seuraavasti:
- aloitusannosta (trastutsumabia 4 mg/kg) tai viikoittaista ylläpitoannosta (trastutsumabia 2 mg/kg) varten
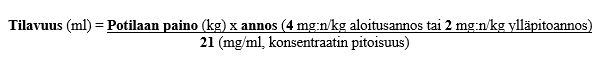
- aloitusannosta (trastutsumabia 8 mg/kg) tai 3 viikon välein annettavaa ylläpitoannosta (trastutsumabia 6 mg/kg) varten

Tarvittava määrä konsentraattia vedetään injektiopullosta käyttäen steriiliä neulaa ja ruiskua ja lisätään polyvinyylikloridista, polyeteenistä tai polypropeenista valmistettuun infuusiopussiin, jossa on 250 ml 0,9-prosenttista natriumkloridiliuosta. Älä käytä glukoosia sisältäviä liuoksia. Liuosta sekoitetaan kääntelemällä pussia varovasti, jotta vältytään liuoksen vaahtoamiselta. Parenteraaliset liuokset on ennen annostelua tarkastettava silmämääräisesti mahdollisten partikkeleiden tai värjäytymien varalta.