Numeta G13E infuusioneste, emulsio
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lapsesi lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, käänny lapsesi lääkärin tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Numeta G13E on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin lapsellesi annetaan Numeta G13E-valmistetta
- Miten Numeta G13E-valmistetta annetaan
- Mahdolliset haittavaikutukset
- Numeta G13E-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Numeta G13E on erityinen keskosille tarkoitettu ravintoemulsio. Se annetaan infuusioletkulla lapsesi laskimoon, kun hän ei pysty syömään kaikkea tarvitsemaansa ravintoa.
Numeta G13E on pakattu kolmiosastoiseen pussiin, jossa yksittäinen osasto sisältää:
- 50 mg/ml glukoosiliuosta
- 5,9 mg/ml elektrolyyttejä sisältävää pediatrista aminohappoliuosta
- 12,5 mg/ml lipidiemulsiota (rasvoja).
Lapsesi tarpeiden mukaisesti näistä liuoksista kaksi tai kolme sekoitetaan keskenään infuusiopussissa, ennen kuin ne annetaan lapsellesi.
Numeta G13E-valmistetta on käytettävä lääkärin valvonnassa.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Lapsellesi ei pidä antaa Numeta G13E‑valmistetta, jos:
Pussi, josta on sekoitettu glukoosi- ja aminohappo/elektrolyytti-liuoksen osastot:
- jos lapsesi on allerginen kananmunalle, soijalle, maapähkinöille tai tämän lääkkeen tai pussin jollekin muulle aineelle (ks. kohta Pakkauksen sisältö ja muuta tietoa).
- jos lapsesi elimistö ei pysty hyödyntämään proteiinien rakennusaineita.
- jos lapsellasi on jonkin Numeta G13E-valmisteen sisältämän elektrolyytin suuri pitoisuus veressä.
- Numeta G13E-valmistetta (tai muita kalsiumia sisältäviä liuoksia) ei saa antaa samanaikaisesti keftriaksonin (antibiootti) kanssa, vaikka käytettäisiin erillisiä infuusioletkuja. On olemassa riski, että vastasyntyneen verenkiertoon muodostuu partikkeleita, mikä voi johtaa kuolemaan.
- jos lapsellasi on hyperglykemia (liian korkea verensokeri).
Pussi, josta on sekoitettu glukoosi-, aminohappo/elektrolyytti- sekä lipidiliuoksen osastot:
Kaikki edellä mainitut tilanteet, joissa pussissa on sekoitettu kaksi liuosta, ja seuraava:
- jos lapsesi veren rasva-arvot ovat erityisen korkeat.
Lääkäri tekee päätöksen siitä, voiko lapsellesi antaa tätä lääkevalmistetta. Lääkärin päätös perustuu lapsen ikään, painoon ja terveydentilaan. Lääkäri ottaa huomioon myös mahdollisten kokeiden tulokset.
Varoitukset ja varotoimet
Keskustele lapsesi lääkärin tai sairaanhoitajan kanssa ennen kuin lapsellesi annetaan Numeta G13E-valmistetta.
Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, emulsio (pusseissa ja antovälineistössä) on suojattava valolta, kunnes emulsion antaminen on saatettu loppuun. Numeta G13E-valmisteen altistaminen ympäristön valolle, erityisesti hivenaineiden ja/tai vitamiinien mukaan sekoittamisen jälkeen, tuottaa peroksideja ja muita hajoamistuotteita, joiden määrää voidaan vähentää suojaamalla valmiste valolta.
Allergiset reaktiot:
Infuusio on lopetettava välittömästi, jos potilaalla esiintyy allergisia reaktioita tai niiden oireita (kuten kuumetta, hikoilua, vilunväreitä, päänsärkyä, ihottumaa tai hengitysvaikeuksia). Tämä lääkevalmiste sisältää soijaöljyä, joka voi harvinaisissa tapauksissa aiheuttaa yliherkkyysreaktioita. Joidenkin maapähkinän proteiineille allergisten henkilöiden on havaittu harvinaisissa tapauksissa olevan allergisia myös soijan proteiineille.
Numeta G13E sisältää glukoosia, joka on peräisin maissitärkkelyksestä. Tämän vuoksi Numeta G13E-valmistetta on annettava varoen potilaille, jotka ovat allergisia maissille tai maissituotteille.
Partikkelien muodostumisen riski keftriaksonin (antibiootti) käytön yhteydessä:
Erästä antibioottia, keftriaksonia, ei saa sekoittaa tai antaa samanaikaisesti minkään laskimoon annettavan kalsiumia sisältävän liuoksen (mukaan lukien Numeta G13E) kanssa. Lääkärisi tietää tämän eikä anna valmisteita yhdessä edes eri infuusioletkuja pitkin tai infuusiokohtien kautta.
Pienten partikkelien muodostuminen keuhkojen verisuonissa:
Hengitysvaikeudet voivat olla merkki pienten partikkelien muodostumisesta, mikä aiheuttaa tukkeumia keuhkojen verisuoniin (keuhkoverenkierron saostumat). Jos lapsellasi on hengitysvaikeuksia, kerro tästä lapsesi lääkärille tai sairaanhoitajalle. He päättävät jatkotoimenpiteistä.
Infektio ja sepsis:
Lääkäri tarkkailee lastasi huolellisesti infektion oireiden varalta. Infektiotartunnan vaaraa voidaan vähentää käyttämällä ns. aseptista tekniikkaa (mikrobitonta tekniikkaa) katetrin asetuksessa ja hoidossa sekä ravintovalmisteen valmistuksessa.
Laskimossa oleva infuusioletku (laskimonsisäinen katetri) voi joskus aiheuttaa lapsille infektion tai sepsiksen (bakteerien aiheuttaman verenmyrkytyksen). Tietyt lääkkeet ja sairaudet voivat suurentaa infektion tai verenmyrkytyksen riskiä. Jos lapsi tarvitsee parenteraalista (laskimoon infuusioletkulla annettavaa) ravintoa, hän voi todennäköisemmin saada infektion terveydentilastaan johtuen.
Rasvakuormitusoireyhtymä:
Rasvakuormitusoireyhtymää on raportoitu samanlaisten valmisteiden käytön yhteydessä. Heikentynyt tai rajoittunut kyky poistaa Numeta G13E-valmisteen sisältämiä lipidejä tai yliannostus saattaa aiheuttaa rasvakuormitukseksi kutsutun oireyhtymän (ks. kohta Miten valmistetta käytetään ja kohta Mahdolliset haittavaikutukset).
Muutokset veren kemiallisessa koostumuksessa:
Lääkäri tarkkailee lapsesi nestetasapainoa, veren kemiallista koostumusta ja muita veriarvoja Numeta G13E‑hoidon aikana. Ravinnon anto vaikeasti aliravitulle potilaalle voi joskus aiheuttaa suuria muutoksia veren kemiallisten aineiden pitoisuuksiin, jotka on mahdollisesti korjattava. Potilaan kudoksiin voi myös kertyä nestettä, mikä aiheuttaa turvotusta. Parenteraalisen ravinnon anto tulisi aloittaa hitaasti ja varovasti.
Seuranta ja annoksen tarkistus:
Lääkäri tarkkailee lastasi huolellisesti ja muuttaa Numeta G13E-valmisteen annostusta lapsen tarpeiden mukaan, etenkin jos hänellä on jokin seuraavista:
- vaikea vammanjälkeinen tila
- vaikea diabetes mellitus
- sokki
- sydäninfarkti
- vaikea infektio
- tietyntyyppinen kooma.
Varovaisuutta on noudatettava:
Numeta G13E-valmistetta on käytettävä varoen lapselle, jos hänellä on:
- keuhkoedeema (nestettä keuhkoissa) tai sydämen vajaatoiminta
- vaikeita maksan toimintahäiriötä
- ongelmia ravinteiden hyväksikäytössä
- korkea verensokeri
- munuaisongelmia
- vaikea aineenvaihdunnan häiriö (elimistö ei pysty hajottamaan aineita normaalisti).
- veren hyytymishäiriöitä.
Lapsesi nestetasapainoa, maksakokeiden arvoja ja/tai muita veriarvoja tarkkaillaan huolellisesti.
On vain vähän tietoja tämän lääkkeen annosta keskosille, joiden gestaatioikä on alle 28 viikkoa.
Muut lääkevalmisteet ja Numeta G13E
Kerro lääkärille, jos lapsesi parhaillaan käyttää, on äskettäin käyttänyt tai saattaa käyttää muita lääkkeitä.
Numeta G13E-valmistetta ei saa antaa samanaikaisesti:
- keftriaksonin (antibiootti) kanssa edes erillisen infuusiolinjan kautta hiukkasten muodostumisen riskin takia.
- veren kanssa samalla infuusiovälineistöllä punasolujen sakkaantumisen vaaran (vuoksi punasolut voivat takertua toisiinsa).
- ampisilliinin, fosfenytoiinin tai furosemidin kanssa saman infuusiolinjan kautta partikkelien muodostumisen riskin takia.
Kumariini ja varfariini (antikoagulantit):
Lääkäri tarkkailee lastasi huolellisesti, jos hän saa kumariinia tai varfariinia. Nämä lääkkeet ovat antikoagulantteja, joilla estetään veren hyytyminen. Oliivi- ja soijaöljy sisältävät luonnostaan K1-vitamiinia. K1-vitamiini voi vaikuttaa tiettyihin lääkkeisiin, kuten kumariiniin ja varfariiniin.
Laboratoriokokeet:
Emulsion sisältämät lipidit voivat vääristää tiettyjen laboratoriotestien tuloksia. Laboratoriotestejä voidaan tehdä, kun potilaalle ei ole annettu lipidejä 5–6 tuntiin tai kun lisälipidejä ei anneta.
Numeta G13E-valmisteen ja kaliumpitoisuuteen/aineenvaihduntaan mahdollisesti vaikuttavien lääkkeiden yhteisvaikutukset:
Numeta G13E sisältää kaliumia. Veren suuri kaliumpitoisuus voi aiheuttaa epänormaalin sydämen rytmin. Erityistä varovaisuutta on noudatettava potilailla, jotka käyttävät diureetteja (nesteen kertymistä vähentäviä lääkkeitä) tai ACE-estäjiä (verenpainetta alentavia lääkkeitä) tai angiotensiini II:n reseptorin salpaajia (verenpainetta alentavia lääkkeitä) tai immunosuppressantteja (lääkkeitä, jotka voivat alentaa elimistön normaalia immuunipuolustusta.) Nämä lääkkeet voivat suurentaa kaliumpitoisuutta.
3. Miten valmistetta käytetään
Lapsellesi annetaan Numeta G13E‑valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista lääkäriltäsi, mikäli olet epävarma.
Kohderyhmä
Numeta G13E on tarkoitettu keskosten ravitsemustarpeisiin.
Numeta G13E ei välttämättä sovi joillekin keskosille, joiden ravitsemustarpeiden täyttäminen voi vaatia yksilöllisten liuosten käyttöä. Lääkäri päättää, onko tämä lääke sopiva lapsellesi.
Annostelu
Tämä lääke on infuusioneste, emulsio, Se annetaan muoviletkulla lapsen käsivarren laskimoon tai rintakehän suureen laskimoon.
Lääkäri voi päättää olla antamatta lapsellesi lipidejä. Numeta G13E-pussin suunnittelu antaa mahdollisuuden rikkoa tarvittaessa vain yhden sauman aminohappo/elektrolyytti- ja glukoosiosaston välillä. Tällöin aminohappo-osaston- ja lipidiemulsio-osaston välinen sauma jää tässä tapauksessa ehjäksi. Pussin sisältö voidaan tämän jälkeen infusoida ilman lipidejä.
Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, emulsio (pusseissa ja antovälineistössä) on suojattava valolta, kunnes emulsion antaminen on saatettu loppuun (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Annos ja hoidon kesto
Lääkäri päättää, kuinka paljon ja kuinka kauan valmistetta annetaan. Annos riippuu lapsesi ravitsemustarpeista. Annos perustuu lapsesi painoon, terveydentilaan ja hänen elimistönsä kykyyn hajottaa ja käyttää Numeta G13E-valmisteen aineosia. Lisäravintoa tai -proteiinia voidaan antaa myös suun/suoliston kautta.
Jos lapsellesi annetaan liikaa Numeta G13E-valmistetta
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111 Suomessa, 112 Ruotsissa) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Oireet
Liian suuri annos tai liian nopea lääkkeen anto voivat aiheuttaa seuraavia oireita:
- pahoinvointi
- oksentelu
- vilunväreet
- elektrolyyttihäiriöt (elektrolyyttien väärä pitoisuus veressä)
- hypervolemia (verenkierron tilavuuden suureneminen, liian suuri nestemäärä verisuonissa)
- asidoosi (veren happamoituminen).
Näissä tapauksissa infuusio on lopetettava heti. Lapsen lääkäri päättää lisätoimenpiteistä.
Numeta G13E-valmisteen sisältämien lipidien yliannostus voi aiheuttaa “rasvakuormitusoireyhtymän”, joka tavallisesti häviää infuusion lopettamisen jälkeen. Vastasyntyneillä ja pienillä lapsilla (vauvoilla) rasvakuormitusoireyhtymä on yhdistetty hengityshäiriöön, joka johtaa alentuneeseen hapen määrään kehossa (hengitysvaikeudet) ja tiloihin, jotka johtavat veren happamuuden lisääntymiseen (asidoosi).
Lääkäri valvoo lapsesi vointia ja veriarvoja säännöllisesti hoidon aikana, jotta nämä oireet vältettäisiin.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki lapset eivät kuitenkaan niitä saa.
Kerro heti lääkärille tai hoitajalle, jos lapsesi vointi muuttuu hoidon aikana tai sen jälkeen.
Lääkärin lapselle määräämät kokeet lääkevalmisteen ottamisen aikana pienentävät haittavaikutusten riskiä.
Jos allergisen reaktion oireita ilmenee, infuusio on lopetettava välittömästi ja otettava yhteyttä lääkäriin. Tämä voi olla vakavaa ja siihen voi liittyä seuraavia oireita:
- hikoilu
- vilunväreet
- päänsärky
- ihottuma
- hengitysvaikeudet.
Muut havaitut haittavaikutukset:
Yleiset: voi esiintyä enintään yhdellä käyttäjällä 10:stä
- Veren matala fosfaattipitoisuus (hypofosfatemia)
- Korkea verensokeri (hyperglykemia)
- Veren suuri kalsiumpitoisuus (hyperkalsemia)
- Veren suuri triglyseridipitoisuus (hypertriglyseridemia)
- Elektrolyyttihäiriöt (hyponatremia).
Melko harvinaiset: voi esiintyä enintään yhdellä käyttäjällä 100:sta
- Veren suuri lipidipitoisuus (hyperlipidemia)
- Tila, jossa sappineste ei pääse virtaamaan maksasta pohjukaissuoleen (kolestaasi). Pohjukaissuoli on suoliston osa.
Tuntematon: koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin (Näitä haittavaikutuksia on raportoitu vain Numeta G13E ja G16E-valmisteille, kun niitä on annettu ääreislaskimoon riittämättömällä laimennuksella)
- Ihon kudoskuolio
- Pehmytkudosvaurio
- Lääkkeen vuotaminen verisuonen ulkopuolelle (ekstravasaatio).
Seuraavia haittavaikutuksia on raportoitu muihin parenteraalisiin ravitsemusvalmisteisiin liittyen:
- Heikentynyt tai rajoittunut kyky poistaa Numeta G13E-valmisteen sisältämiä lipidejä voi aiheuttaa rasvakuormitusoireyhtymän. Seuraavat rasvakuormituksen oireet ja merkit häviävät tavallisesti, kun lipidiemulsioinfuusio lopetetaan:
Potilaan terveydentilan äkillinen ja odottamaton heikentyminen
- Veren suuri lipidipitoisuus (hyperlipidemia)
- Kuume
- Rasvan kertyminen maksaan (hepatomegalia)
- Maksan toiminnan heikentyminen
- Punasolujen määrän väheneminen (anemia), joka voi aiheuttaa kalpeutta ja heikkoutta tai hengitysvaikeuksia
- Valkosolujen niukkuus (leukopenia), joka voi suurentaa infektiotartunnan vaaraa
- Verihiutaleiden niukkuus (trombosytopenia), joka voi suurentaa mustelmien ja/tai verenvuodon vaaraa
- Koagulaatiohäiriöt, jotka vaikuttavat veren hyytymiseen
- Hengityshäiriöt. jotka johtavat alentuneeseen hapen määrään kehossa (hengitysvaikeudet)
- Tilat, jotka johtavat veren happamuuden lisääntymiseen (asidoosi)
- Kooma, joka edellyttää sairaalahoitoa.
Pienten partikkelien muodostuminen, mikä voi johtaa tukkeumiin keuhkoverisuonissa (keuhkoverenkierron saostumat) ja hengitysvaikeuksiin.
Haittavaikutuksista ilmoittaminen
Jos havaitset lapsellasi haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville, kun valmistetta ei anneta.
Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, emulsio (pusseissa ja antovälineistössä) on suojattava valolta, kunnes emulsion antaminen on saatettu loppuun (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Älä käytä tätä lääkettä pakkauksessa ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Ei saa jäätyä.
Säilytettävä päällyspussissa.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Lääkevalmisteen kuvaus ja pakkauskoot
Numeta G13E on pakattu kolmiosastoiseen pussiin. Yksi pussi sisältää steriiliä glukoosiliuosta, lapsille tarkoitettua elektrolyyttejä sisältävää aminohappoliuosta ja lipidiemulsiota seuraavat määrät:
| Pussikoko | Glukoosiliuos, 50 g/100 ml | Elektrolyyttjeä sisältävä aminohappoliuos, 5,9 g/100 ml | Lipidiemulsio, 12,5 g/ml |
| 300 ml | 80 ml | 160 ml | 60 ml |
Ulkonäkö ennen sekoitusta:
- Aminohappo- ja glukoosiliuokset ovat kirkkaita, värittömiä tai hieman kellertäviä.
- Lipidiemulsio on homogeeninen ja maitomaisen valkoinen neste.
Ulkonäkö sekoituksen jälkeen:
- Kun pussista on sekoitettu kahden osaston sisältö (aminohappo/elektrolyytti- ja glukoosiliuokset) infuusiota varten, liuos on kirkasta ja väritöntä tai hieman kellertävää.
- Kun pussista on sekoitettu kolmen osaston sisältö, emulsio on homogeenista ja maitomaisen valkoista.
Kolmiosastoinen pussi on monikerroksinen muovipussi.
Jotta valmisteeseen ei pääse ilmaa, Numeta G13E on pakattu happitiiviiseen päällyspussiin, jossa on myös happea imevä tyyny ja happi-indikaattori.
Pakkauskoot
300 ml:n pussi: 10 pussia laatikossa.
1 pussi, jossa 300 ml.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija
Baxter Oy
PL 119
00181 Helsinki
Valmistaja
Baxter S.A.
Boulevard Rene Branquart, 80
7860 Lessines
Belgia
Tämä pakkausseloste on tarkistettu viimeksi 26.06.2024
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille*
*Huomioi, että tietyissä tapauksissa vanhemmat tai muut huoltajat voivat annostella tätä lääkettä kotona. Sellaisissa tapauksissa vanhempien/huoltajien pitää lukea seuraavat tiedot.
Pussiin ei saa lisätä muita aineita, ennen kuin niiden yhteensopivuus on varmistettu. Muutoin valmisteeseen voi saostua hiukkasia tai lipidiemulsion rakenne voi muuttua. Se voi aiheuttaa verisuonitukoksen.
Numeta G13E-valmisteen tulee olla annettaessa huoneenlämpöistä.
Numeta G13E-pussi valmistellaan seuraavasti ennen lääkevalmisteen käyttöä.
Varmista, että pussi on ehjä. Älä käytä pussia, jos se on vahingoittunut. Ehjä pussi näyttää tältä:
- Avautuvat saumat ovat ehjät. Tällöin minkään kolmen osaston sisältö ei ole sekoittunut.
- Aminohappo- ja glukoosiliuokset ovat kirkkaita ja värittömiä tai kellertäviä, eikä niissä ole näkyviä hiukkasia.
- Lipidiemulsio on homogeeninen ja maitomaisen valkoinen neste.
Ennen kuin avaat päällyspussin, tarkista happi-indikaattorin väri.
- Vertaa sitä OK-symbolin vieressä näkyvään vertailuväriin, joka on indikaattorin etiketin tulostetulla alueella.
- Älä käytä pussia, jos happi-indikaattorin väri ei ole sama kuin OK-symbolin vieressä näkyvä vertailuväri.
Kuvassa 1 ja 2 kuvataan kuinka suojaava päällyspussi poistetaan. Hävitä päällyspussi, happi-indikaattori ja happea imevä tyyny.

Sekoitetun emulsion valmisteleminen:
- Valmisteen on oltava huoneenlämpöistä, kun avaat osastojen väliset saumat.
- Aseta pussi vaakasuoralle ja puhtaalle alustalle.
Kolmen osaston sisällön sekoittaminen (kolmen liuoksen sekoittaminen kaksi saumaa avaamalla)
Vaihe 1: Ala rullata pussia D-ripustinpäästä.

Vaihe 2: Avaa sauma painamalla.

Vaihe 3: Muuta sitten suuntaa rullaamalla pussia kohti D-ripustinta.
Jatka rullaamista kunnes sauma on täysin auki.
Etene samaan suuntaan toisen sauman avaamiseksi.

Vaihe 4: Sekoita pussin sisältö huolellisesti kääntämällä pussi ylösalaisin vähintään kolme kertaa.
Sekoitettu liuos on maitomaisen valkoinen emulsio.

Vaihe 5: Irrota suojus annosteluportista ja kiinnitä siihen infuusioletkusto.

Kahden osaston sisällön sekoittaminen (kahden liuoksen sekoittaminen avaamalla aminohappo- ja glukoosikammioiden välinen sauma)
Vaihe 1: Jos sekoitat vain kaksi liuosta, rullaa pussia yläreunasta (ripustinpäästä) kahden liuoksen välisen sauman nurkasta.
Avaa glukoosi- ja aminohappoliuosten välinen sauma painamalla.

Vaihe 2: Aseta pussi niin, että lipidiemulsio-osasto on lähimpänä itseäsi.

Rullaa pussia ja suojaa samalla lipidiemulsio-osastoa kämmenilläsi.

Vaihe 3: Rullaa painamalla pussia toisella kädellä porttien suuntaan.

Vaihe 4: Vaihda suuntaa ja rullaa pussia yläreunan (ripustinpään) suuntaan.
Paina pussia toisella kädellä, kunnes aminohappo- ja glukoosiliuososastojen välinen sauma on kokonaan auki.

Vaihe 5: Sekoita pussin sisältö huolellisesti kääntämällä pussi ylösalaisin vähintään kolme kertaa.
Sekoitettu liuos on kirkasta, väritöntä tai hieman kellertävää.

Vaihe 6: Irrota suojus annosteluportista ja kiinnitä siihen infuusioletkusto.

Infuusionopeutta suurennetaan vähitellen ensimmäisen tunnin aikana. Antonopeutta määrättäessä on otettava huomioon seuraavat tekijät:
- annoksen suuruus
- saantitilavuus vuorokaudessa
- infuusion kesto.
Antotapa
Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, emulsio (pusseissa ja antovälineistössä) on suojattava valolta, kunnes emulsion antaminen on saatettu loppuun.
1,2 mikrometrin suodattimen käyttöä suositellaan Numeta G13E-valmisteen annostelussa.
Korkean osmolarisuutensa takia laimentamaton Numeta G13E-valmiste voidaan antaa vain keskuslaskimoon. Jos Numeta G13E-valmistetta kuitenkin laimennetaan riittävästi injektionesteisiin käytettävällä vedellä, sen osmolariteetti laskee ja se voidaan antaa ääreislaskimoon. Alla olevalla kaavalla esitetään, miten laimennus vaikuttaa pussien sisällön osmolarisuuteen:
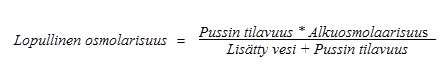
Alla olevassa taulukossa on esimerkkejä pussien sisällön osmolaarisuudesta injektionesteisiin käytettävän veden lisäämisen jälkeen, kun pussista on sekoitettu kahden tai kolmen osaston sisältö:
| | Aminohappo- ja glukoosiliuos (kaksi osastoa sekoitettu) | Aminohappo- ja glukoosiliuos sekä lipidiemulsio (kolme osastoa sekoitettu) |
| Pussin alkutilavuus (ml) | 240 | 300 |
| Pussin alkuosmolaarisuus (mOsm/l, n.) | 1400 | 1150 |
| Lisätyn veden tilavuus (ml) | 240 | 300 |
| Lopullinen tilavuus lisäysten jälkeen (ml) | 480 | 600 |
| Osmolaarisuus lisäysten jälkeen (mOsm/l, n.) | 700 | 575 |
Lisäykset
Laskimonsisäisen parenteraalisen ravinneliuoksen altistaminen valolle voi, erityisesti hivenaineiden ja/tai vitamiinien mukaan sekoittamisen jälkeen, vaikuttaa haitallisesti vastasyntyneiden hoitotulokseen peroksidien ja muiden hajoamistuotteiden muodostumisen takia. Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, Numeta G13E on suojattava ympäristön valolta, kunnes sen antaminen on saatettu loppuun.
Yhteensopivien aineiden lisäykset voidaan tehdä injektioportin kautta käyttökuntoon saatettuun seokseen (kun osastojen väliset saumat on avattu ja kahden tai kolmen pussin sisältö on sekoitettu).
Vitamiineja voidaan lisätä myös glukoosia sisältävään osastoon ennen kuin sekoittamista (ennen saumojen avaamista ja liuoksen ja emulsion sekoittamista).
Mahdolliset kaupallisten hivenainevalmisteiden (eli HA1- ja HA4-valmisteiden), vitamiinivalmisteiden (eli V1- ja V2- kuiva-aineiden) ja elektrolyyttien lisäykset tietyissä määrissä on esitetty alla olevissa taulukossa 1–4.
- Yhteensopivuus HA4-, V1- ja V2-valmisteiden kanssa
Taulukko 1: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 300 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) |
| | Laimentamaton seos | Laimennettu seos |
| Lisäykset | Valmis-teessa | Enimmäislisäys | Sisältää enintään | Valmis-teessa | Enimmäis-lisäys | Sisältää enintään |
| Natrium (mmol) | 6,6 | 5,0 | 11,6 | 6,6 | 5,0 | 11,6 |
| Kalium (mmol) | 6,2 | 4,2 | 10,4 | 6,2 | 4,2 | 10,4 |
| Magnesium (mmol) | 0,47 | 0,83 | 1,3 | 0,47 | 0,83 | 1,3 |
| Kalsium (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 3,5 | 7,3 |
| Fosfaatti* (mmol) | 3,8 | 2,5 | 6,3 | 3,8 | 2,5 | 6,3 |
| Hivenaineet ja vitamiinit | - | 15 ml HA4-valmistetta + 1,5 injektio-pulloa V1-valmistetta + 25 ml V2-valmistetta | 15 ml HA4-valmistetta + 1,5 injektio-pulloa V1-valmistetta + 25 ml V2-valmistetta | - | 15 ml HA4-valmistetta + 1,5 injektio-pulloa V1- + 25 ml V2-valmistetta | 15 ml HA4-valmistetta + 1,5 injektio-pulloa V1-valmistetta + 25 ml V2-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 300 ml | 300 ml |
* Orgaaninen fosfaatti
Taulukko 2: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 240 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) |
| | Laimentamaton seos | Laimennettu seos |
| Lisäykset | Valmis-teessa | Enimmäislisäys | Sisältää enintään | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 6,4 | 17,6 | 24 | 6,4 | 0,0 | 6,4 |
| Kalium (mmol) | 6,2 | 17,8 | 24 | 6,2 | 0,0 | 6,2 |
| Magnesium (mmol) | 0,47 | 2,13 | 2,6 | 0,47 | 0,0 | 0,47 |
| Kalsium (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosfaatti* (mmol) | 3,2 | 4,0 | 7,2 | 3,2 | 0,0 | 3,2 |
| Hivenaineet ja vitamiinit | - | 2,5 ml HA4-valmistetta + ¼ injektiopulloa V1-valmistetta | 2,5 ml HA4-valmistetta + ¼ injektio-pulloa V1-valmistetta | - | 2,5 ml HA4-valmistetta + ¼ injektiopulloa V1-valmistetta | 2,5 ml HA4-valmistetta + ¼ injektio-pulloa V1-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 240 ml | 240 ml |
* Orgaaninen fosfaatti
- Yhteensopivuus HA1-, V1- ja V2-valmisteiden kanssa
Taulukko 3: Yhteensopivuus, kun kolmen osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 300 ml (aminohapot, glukoosi ja lipidit (kolme osastoa sekoitettu)) |
| | Laimentamaton seos | Laimennettu seos |
| Lisäykset | Valmis-teessa | Enimmäislisäys | Sisältää enintään | Valmis-teessa | Enimmäis-lisäys | Sisältää enintään |
| Natrium (mmol) | 6,6 | 5,0 | 11,6 | 6,6 | 0,0 | 6,6 |
| Kalium (mmol) | 6,2 | 4,2 | 10,4 | 6,2 | 0,0 | 6,2 |
| Magnesium (mmol) | 0,47 | 0,83 | 1,3 | 0,47 | 0,0 | 0,47 |
| Kalsium (mmol) | 3,8 | 1,9 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosfaatti* (mmol) | 3,8 | 2,5 | 6,3 | 3,8 | 0,0 | 3,8 |
| Hivenaineet ja vitamiinit | - | 2,5 ml HA1-valmistetta + ¼ injektiopulloa V1-valmistetta + 2,5 ml V2-valmistetta | 2,5 ml HA1-valmistetta + ¼ injektio-pulloa V1-valmistetta + 2,5 ml V2-valmistetta | - | 2,5 ml HA1-valmistetta + ¼ injektio-pulloa V1-valmistetta + 2,5 ml V2-valmistetta | 2,5 ml HA1-valmistetta + ¼ injektio-pulloa V1-valmistetta + 2,5 ml V2-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 300 ml | 300 ml |
* Orgaaninen fosfaatti
Taulukko 4: Yhteensopivuus, kun kahden osaston sisältö on sekoitettu laimennettuna tai ilman laimennusta veden kanssa
| Per 240 ml (aminohapot ja glukoosi (kaksi osastoa sekoitettu)) |
| | Laimentamaton seos | Laimennettu seos |
| Lisäykset | Valmis-teessa | Enimmäislisäys | Sisältää enintään | Valmis-teessa | Enimmäislisäys | Sisältää enintään |
| Natrium (mmol) | 6,4 | 17,6 | 24 | 6,4 | 0,0 | 6,4 |
| Kalium (mmol) | 6,2 | 17,8 | 24 | 6,2 | 0,0 | 6,2 |
| Magnesium (mmol) | 0,47 | 2,13 | 2,6 | 0,47 | 0,0 | 0,47 |
| Kalsium (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosfaatti* (mmol) | 3,2 | 4,0 | 7,2 | 3,2 | 0,0 | 3,2 |
| Hivenaineet ja vitamiinit | - | 2,5 ml HA1-valmistetta + ¼ injektiopulloa V1-valmistetta | 2,5 ml HA1-valmistetta + ¼ injektio-pulloa V1-valmistetta | - | 2,5 ml HA1-valmistetta + ¼ injektiopulloa V1-valmistetta | 2,5 ml HA1-valmistetta + ¼ injektio-pulloa V1-valmistetta |
| Injektionesteisiin käytetty vesi | - | - | - | - | 240 ml | 240 ml |
* Orgaaninen fosfaatti
Vitamiini- ja hivenainevalmisteiden koostumus on esitetty alla olevissa taulukoissa 5 ja 6.
Taulukko 5: Käytettyjen kaupallisten hivenainevalmisteiden koostumus:
| Injektiopullon koostumus | HA1-valmiste (10 ml) | HA4-valmiste (10 ml) |
| Sinkki | 38,2 mikromol tai 2,5 mg | 15,3 mikromol tai 1 mg |
| Seleeni | 0,253 mikromol tai 0,02 mg | 0,253 mikromol tai 0,02 mg |
| Kupari | 3,15 mikromol tai 0,2 mg | 3,15 mikromol tai 0,2 mg |
| Jodi | 0,0788 mikromol tai 0,01 mg | 0,079 mikromol tai 0,01 mg |
| Fluori | 30 mikromol tai 0,57 mg | - |
| Mangaani | 0,182 mikromol tai 0,01 mg | 0,091 mikromol tai 0,005 mg |
Taulukko 6: Käytettyjen kaupallisen vitamiinivalmisteen koostumus:
| Injektiopullon koostumus | V1-valmiste | V2-valmiste |
| B1-vitamiini | 2,5 mg | - |
| B2-vitamiini | 3,6 mg | - |
| Nikotiiniamidi | 40 mg | - |
| B6-vitamiini | 4,0 mg | - |
| Pantoteenihappo | 15,0 mg | - |
| Biotiini | 60 mikrog | - |
| Foolihappo | 400 mikrog | - |
| B12-vitamiini | 5,0 mikrog | - |
| C-vitamiini | 100 mg | - |
| A-vitamiini | - | 2300 KY |
| D-vitamiini | - | 400 KY |
| E-vitamiini | - | 7 KY |
| K-vitamiini | - | 200 mikrog |
Lisäysten teko:
- Noudata aseptista tekniikkaa.
- Valmistele pussin injektioportti.
- Lävistä injektioportti ja injisoi lisäykset käyttämällä injektioneulaa tai käyttökuntoon saattamiseen tarkoitettavaa laitetta.
- Sekoita pussin sisältö lisäysten kanssa.
Infuusion valmistelu:
- Noudata aseptista tekniikkaa.
- Ripusta pussi infuusiotelineeseen.
- Poista annosteluportin muovisuojus.
- Aseta infuusiosetin piikki tiiviisti annosteluporttiin.
Infuusion anto:
- Vain kerta-antoon
- Anna valmiste ainoastaan vasta kun kahden tai kolmen osaston väliset saumat on avattu ja kahden tai kolmen osaston sisältö on sekoitettu.
- Varmista, että lopullisessa aktivoidussa emulsiossa, jossa kolmen osaston sisältö on sekoitettu, ei ole faasierottumista tai lopullisessa liuoksessa, jossa kahden osaston sisältö on sekoitettu, ei ole hiukkasia.
Valmisteen käyttämistä suositellaan välittömästi, kun osastojen väliset saumat on avattu. Valmistetta ei saa säilyttää myöhempää infuusiota varten.
- Älä yhdistä osittain käytettyjä pussseja toisiinsa.
- Älä kytke pusseja sarjaan välttääksesi ilmaembolismin riskin ensimmäiseen pussiin mahdollisesti jääneestä ilmasta johtuen.
- 1,2 mikrometrin suodattimen käyttöä suositellaan Numeta G13E-valmisteen annostelussa.
- Kun valmistetta käytetään vastasyntyneillä ja alle 2-vuotiailla lapsilla, se on suojattava valolta, kunnes sen antaminen on saatettu loppuun. Numeta G13E-valmisteen altistaminen ympäristön valolle, erityisesti hivenaineiden ja/tai vitamiinien mukaan sekoittamisen jälkeen, tuottaa peroksideja ja muita hajoamistuotteita, joiden määrää voidaan vähentää suojaamalla valmiste valolta.
- Käyttämätön valmiste ja kaikki tarpeelliset kertakäyttöiset tarvikkeet on hävittettävä asianmukaisesti.
Kestoaika liuosten sekoituksen jälkeen
Käytä valmiste heti, kun kahden tai kolmen osaston väliset saumat on avattu. Sekoitetun valmisteen on osoitettu säilyvän enintään 7 päivän ajan 2–8 °C:n lämpötilassa ja sen jälkeen enintään 48 tuntia 30 °C:n lämpötilassa.
Kestoaika lisäysten (elektrolyytit, hivenaineet, vitamiinit, vesi) jälkeen
Numeta G13E-formulaation, johon on lisätty tiettyjä aineita, on osoitettu säilyvän fysikaalisesti stabiilina enintään 7 päivän ajan 2–8 °C:n lämpötilassa ja sen jälkeen enintään 48 tuntia 30 °C:n lämpötilassa.
Tietoa näistä lisäyksistä on annettu valmistyhteenvedon kohdassa 6.6.
Mikrobiologiselta kannalta valmiste olisi käytettävä heti. Jos valmistetta ei käytetä heti, säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla. Säilytysaika ei tavallisesti saa ylittää 24 tuntia 2–8 ºC:ssa, ellei aineita ole lisätty valvotuissa ja validoiduissa aseptisissa olosuhteissa.
Älä käytä Numeta G13E-valmistetta, jos pussi on vahingoittunut. Vahingoittunut pussi näyttää tältä:
- Avautuvat saumat ovat rikki.
- Minkä tahansa osaston sisältö on sekoittunut toisen liuoksen kanssa.
- Aminohappo- ja glukoosiliuokset eivät ole kirkkaita ja värittömiä tai kellertäviä, ja/tai niissä on näkyviä hiukkasia.
- Lipidiemulsio ei ole homogeeninen ja maitomaisen valkoinen.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Mitä Numeta G13E sisältää
Vaikuttavat aineet ovat:
| Vaikuttava aine | Kaksi osastoa sekoitettu (240 ml) | Kolme osastoa sekoitettu (300 ml) |
| Aminohappo-osasto |
| Alaniini | 0,75 g | 0,75 g |
| Arginiini | 0,78 g | 0,78 g |
| Asparagiinihappo | 0,56 g | 0,56 g |
| Kysteiini | 0,18 g | 0,18 g |
| Glutamiinihappo | 0,93 g | 0,93 g |
| Glysiini | 0,37 g | 0,37 g |
| Histidiini | 0,35 g | 0,35 g |
| Isoleusiini | 0,62 g | 0,62 g |
| Leusiini | 0,93 g | 0,93 g |
Lysiinimonohydraatti (lysiininä) | 1,15 g (1,03 g) | 1,15 g (1,03 g) |
| Metioniini | 0,22 g | 0,22 g |
Ornitiinihydrokloridi (ornitiinina) | 0,30 g (0,23 g) | 0,30 g (0,23 g) |
| Fenyylialaniini | 0,39 g | 0,39 g |
| Proliini | 0,28 g | 0,28 g |
| Seriini | 0,37 g | 0,37 g |
| Tauriini | 0,06 g | 0,06 g |
| Treoniini | 0,35 g | 0,35 g |
| Tryptofaani | 0,19 g | 0,19 g |
| Tyrosiini | 0,07 g | 0,07 g |
| Valiini | 0,71 g | 0,71 g |
| Kaliumasetaatti | 0,61 g | 0,61 g |
| Kalsiumklorididihydraatti | 0,55 g | 0,55 g |
| Magnesiumasetaattitetrahydraatti | 0,10 g | 0,10 g |
| Natriumglyserofosfaatti, hydratoitu | 0,98 g | 0,98 g |
| Glukoosiosasto |
| Glukoosimonohydraatti (vedettömänä glukoosina) | 44,00 g (40,00 g ) | 44,00 g (40,00 g ) |
| Lipidiosasto |
| Puhdistettu oliiviöljy (noin 80 %) + puhdistettu soijaöljy (noin 20 %) | - | 7,5 g |
| |
Käyttökuntoon saatetun Numeta G13E-liuoksen/-emulsion koostumus:
| Koostumus | Kaksi osastoa sekoitettu | Kolme osastoa sekoitettu |
| Tilavuusyksikköä kohden (ml) | 240 | 100 | 300 | 100 |
| Typpi (g) | 1,4 | 0,59 | 1,4 | 0,47 |
| Aminohapot (g) | 9,4 | 3,9 | 9,4 | 3,1 |
| Glukoosi (g) | 40,0 | 16,7 | 40,0 | 13,3 |
| Lipidit (g) | 0 | 0 | 7,5 | 2,5 |
| Energia | | | | |
| Kokonaiskalorit (kcal) | 198 | 82 | 273 | 91 |
| Proteiinittomat kalorit (kcal) | 160 | 67 | 235 | 78 |
| Glukoosikalorit (kcal) | 160 | 67 | 160 | 53 |
| Lipidikalorita (kcal) | 0 | 0 | 75 | 25 |
| Proteiinittomat kalorit / typpi (kcal/g typpi) | 113 | 113 | 165 | 165 |
| Lipidikalorit (% proteiinittomista kaloreista) | Ei oleellinen | Ei oleellinen | 32 | 32 |
| Lipidikalorit (% kokonaiskaloreista) | Ei oleellinen | Ei oleellinen | 28 | 28 |
| Elektrolyytit | | | | |
| Natrium (mmol) | 6,4 | 2,7 | 6,6 | 2,2 |
| Kalium (mmol) | 6,2 | 2,6 | 6,2 | 2,1 |
| Magnesium (mmol) | 0,47 | 0,20 | 0,47 | 0,16 |
| Kalsium (mmol) | 3,8 | 1,6 | 3.8 | 1,3 |
| Fosfaattib (mmol) | 3,2 | 1,3 | 3.8 | 1,3 |
| Asetaatti (mmol) | 7,2 | 3,0 | 7,2 | 2,4 |
| Malaatti (mmol) | 3,2 | 1,3 | 3,2 | 1,1 |
| Kloridi (mmol) | 9,3 | 3,9 | 9,3 | 3,1 |
| pH (n.) | 5,5 | 5,5 | 5,5 | 5,5 |
| Osmolaarisuus n. (mOsm/l) | 1400 | 1400 | 1150 | 1150 |
a Sisältää kananmunan fosfolipidien (injektionestettä varten) kalorit. b Sisältää lipidiemulsion sisältämän kananmunan fosfolipidien (injektionestettä varten) fosfaatin. |
Muut aineet ovat:
| L-omenahappoa |
| Suolahappoa |
| Fosfolipidit (muna) injektionestettä varten |
| Glyseroli |
| Natrium oleaatti |
| Natriumhydroksidia |
| Injektionesteisiin käytettävä vesi |
a pH:n säätöön