Eylea 40 mg/ml injektioneste, liuos, injektiopullossa
aflibersepti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin saat tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia joita ei ei mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Eylea on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Eylea-valmistetta
- Miten Eylea-valmistetta annetaan
- Mahdolliset haittavaikutukset
- Eylea-valmisteen säilyttäminen
- Pakkauksen sisältä ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Eylea on liuos, joka annetaan injektiona silmään. Sillä hoidetaan aikuisten silmäsairauksia nimeltä
- kostea silmänpohjan ikärappeuma, johon liittyy verisuonten uudismuodostusta silmässä
- näkökyvyn heikkeneminen, joka johtuu verkkokalvon laskimotukoksen (haaralaskimotukos (BRVO) tai keskuslaskimotukos (CRVO)) aiheuttamasta silmänpohjan turvotuksesta
- näkökyvyn heikkeneminen, joka johtuu diabeettisesta makulaturvotuksesta
- näkökyvyn heikkeneminen, joka johtuu likitaitteisuuden aiheuttamasta suonikalvon uudissuonittumisesta (myooppinen CNV).
Aflibersepti, Eylea-valmisteen aktiivinen aine, estää verisuonikasvutekijöiden VEGF-A:n (verisuoniston endoteelin kasvutekijä A) ja PlGF:n (plasentaalinen kasvutekijä) toimintaa.
Kosteaa silmänpohjan ikärappeumaa ja likitaitteisuuden aiheuttamaa suonikalvon uudissuonittumista sairastavilla potilailla näiden tekijöiden liiallinen toiminta aiheuttavat epänormaalien uusien verisuonien muodostumisen silmässä. Nämä uudet poikkeavat verisuonet voivat aiheuttaa veren aineosien vuotamista silmään ja ajan myötä vahingoittaa näkökyvystä vastaavia silmän kudoksia.
Potilailla, joilla on verkkokalvon keskuslaskimotukos, on tukos tärkeimmässä verta verkkokalvosta poispäin kuljettavassa verisuonessa. Verisuonikasvutekijöiden tasot ovat koholla, jolloin nestettä vuotaa verkkokalvoon. Tämä aiheuttaa makulan(verkkokalvon tarkkaan näkemiseen liittyvä osa) turpoamisen eli makulaarisen edeeman. Jos makulassa on turvotusta ja nestettä, keskeinen näkö sumenee.
Potilailla, joilla on verkkokalvon haaralaskimotukos, on tukos yhdessä tai useammassa tärkeimmän verta verkkokalvosta poispäin kuljettavan verisuonen haarassa. Verisuonikasvutekijöiden tasot ovat koholla, jolloin nestettä vuotaa verkkokalvoon. Tämä aiheuttaa makulan turpoamisen eli makulaarisen edeeman.
Diabeettinen makulaturvotus on verkkokalvon turvotus, jota esiintyy diabetesta sairastavilla potilailla ja joka johtuu makulan verisuonista vuotavasta nesteestä. Makula on verkkokalvon tarkkaan näkemiseen liittyvä alue. Jos makulassa on turvotusta ja nestettä, keskeinen näkö sumenee.
Eylea-valmisteen on osoitettu pysäyttävän uusien epänormaalien, usein nestettä tai verta vuotavien verisuonten kasvun silmässä. Eylea voi auttaa vakauttamaan ja monissa tapauksissa parantamaan silmänpohjan kosteaan ikärappeumaan, verkkokalvon keskuslaskimotukokseen, haaralaskimotukokseen, diabeettiseen makulturvotukseen ja likitaitteisuuden aiheuttamaan suonikalvon uudissuonittumiseen liittyvää näönmenetystä.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle EI anneta Eylea-valmistetta,
- jos olet allerginen afliberseptille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on aktiivinen tai epäilty tulehdus silmässä tai sen ympärillä (silmä- tai silmänympärysinfektio)
- jos sinulla on vakava tulehdusreaktio silmässä (oireena kipu tai punoitus).
Varoitukset ja varotoimet
Keskustele lääkärin kanssa, ennen kuin sinulle annetaan Eylea-valmistetta:
- jos sinulla on silmänpainetauti (glaukooma)
- jos olet aiemmin nähnyt valonvälähdyksiä tai näkökentässä leijuvia läpinäkyviä kuvioita ja jos kuvioiden koko tai määrä äkillisesti lisääntyy.
- jos sinulle on suoritettu tai suunnitellaan suoritettavaksi silmäleikkaus edeltävän tai seuraavan neljän viikon aikana.
- jos sinulla on verkkokalvon keskus- haaralaskimotukoksen vakava muoto (iskeeminen
verkkokalvon keskus- tai haaralaskimotukos), Eylea-hoitoa ei suositella.
Lisäksi on tärkeää tietää, että:
- molempiin silmiin samanaikaisesti annetun Eylea-valmisteen turvallisuutta ja tehoa ei ole tutkittuja samanaikaisesti käytettynä voi johtaa haittavaikutusten esiintymisen
riskin kasvuun - Eylea-injektio voi joillakin potilailla aiheuttaa silmänpaineen (intraokulaarisen paineen) kohoamisen 60 minuutin sisällä ruiskutuksesta. Lääkäri seuraa tätä kunkin ruiskutuksen jälkeen.
- jos sinulle kehittyy silmän sisäosan tulehdus tai tulehdusreaktio (endoftalmiitti) tai saat muita komplikaatioita, sinulla voi ilmetä silmäkipua tai lisääntynyttä epämukavuuden tunnetta silmässä, silmän punoituksen pahenemista, näön sumenemista tai heikkenemistä sekä valoherkkyyden
lisääntymistä. On tärkeää, että kaikki oireet diagnosoidaan ja hoidetaan mahdollisimman nopeasti. - lääkäri tarkistaa, onko sinulla muita riskitekijöitä, jotka voivat lisätä todennäköisyyttä silmän takaosan kerroksien repeämään tai irtoamiseen (verkkokalvon tai sen pigmenttiepiteelin irtoaminen tai repeämä). Tällöin Eylea-valmistetta tulee antaa varoen.
- Eylea-valmistetta ei pidä käyttää raskauden aikana, ellei hoidon mahdollinen hyöty ole sikiölle aiheutuvaa mahdollista riskiä suurempi.
- naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana sekä vähintään kolme kuukautta viimeisen Eylea-injektion jälkeen.
- jos sinulla on diabeteksen aiheuttama silmäsairaus (diabeettinen retinopatia)
Verisuonikasvutekijän estäien, kuten Eylea-valmisteen vaikuttavan aineen, systemaattisen käyttöön voi liittyä verisuonia tukkivien verihyytymien (valtimotukos) riski, mikä puolestaan voi johtaa sydänkohtaukseen tai aivohalvaukseen. Tämä on teoriassa mahdollista Eylea-valmisteen silmänsisäisen annostelun jälkeen. Sellaisten potilaiden hoidon turvallisuudesta, joilla on verkkokalvon keskuslaskimotukos, haaralaskimotukos, diabeettinen makulaturvotus ja likitaitteisuuden aiheuttama suonikalvon uudissuonittuminen ja on ollut aivohalvaus tai ohimenevä aivoverenkiertohäiriö edellisen 6 kuukauden aikana, on saatavana rajallisesti tietoa. Jos jokin näistä koskee sinua, Eylea-valmistetta annetaan varoen.
Seuraavien tapausten hoidosta on vain rajallisesti kokemusta:
- potilaat, joilla on tyypin I diabeteksesta johtuva diabeettinen makulaturvotus
- diabeetikot, joiden verensokeriarvo on hyvin korkea (HbA1c yli 12 %)
- diabeetikot, joilla on diabeteksesta johtuva proliferatiivinen diabeettinen retinopatia.
Seuraavien tapausten hoidosta ei ole kokemusta:
- potilaat, joilla on akuutteja infektioita
- potilaat, joilla on muita silmäsairauksia, kuten verkkokalvon irtoaminen tai makulareikä
- diabeetikot, joiden korkea verenpaine ei ole hoitotasapainossa
- muut kuin aasialaista syntyperää olevat potilaat, joilla on likitaitteisuuden aiheuttama suonikalvon uudissuonittuminen
- potilaat, jotka ovat aiemmin saaneet hoitoa likitaitteisuuden aiheuttamaan suonikalvon uudissuonittumiseen
- likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoito potilailla, joilla on vaurioita makulan keskiosan ulkopuolella (ekstrafoveaalisia leesioita).
Jos jokin näistä koskee sinua, lääkärisi ottaa tämän tietojen puuttellisuuden huomioon hoitaessaan sinua Eylea-valmisteella.
Lapset ja nuoret
Eylea-valmisteen käyttöä alle 18-vuotiaille lapsille tai nuorille ei ole tutkittu, koska kosteaa silmänpohjan ikärappeumaa, verkkokalvon keskuslaskimotukosta, haaralaskimotukosta, diabeettista makulaturvotusta ja likitaitteisuuden aiheuttamaa suonikalvon uudissuonittumista esiintyy pääasiassa aikuisilla. Siksi sen käyttö tälle ikäryhmälle ei ole asianmukaista.
Muut lääkevalmisteet ja Eylea
Kerro lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat joutua käyttämään muita lääkkeitä.
Raskaus ja imetys
- Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana sekä vähintään kolme kuukautta viimeisen Eylea-injektion jälkeen.
- Eylea-valmisteen käytöstä raskaana oleville naisille ei ole kokemuksia. Eylea-valmistetta ei pidä käyttää raskauden aikana, ellei mahdollinen hyöty ole syntymättömälle lapselle aiheutuvaa mahdollista riskiä suurempi. Jos olet raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen Eylea-hoidon saamista.
- Pieniä määriä Eylea-valmistetta voi erittyä ihmisen äidinmaitoon. Vaikutuksia imetettäviin vauvoihin ei tunneta. Eylea-valmistetta ei suositella käytettäväksi imetyksen aikana. Jos imetät, keskustele asiasta lääkärin kanssa ennen Eylea-valmisteen käyttämistä.
Ajaminen ja koneiden käyttö
Eylea-injektion jälkeen sinulla voi ilmetä joitakin väliaikaisia näköhäiriöitä. Älä aja tai käytä koneita, kun näkösi ei ole normaali.
Tärkeää tietoa Eylea-valmisteen sisältämistä aineista
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per annos eli sen voidaan sanoa olevan "natriumiton".
3. Miten valmistetta käytetään
Lääkäri, jolla on kokemusta lääkeinjektioiden antamisesta silmään, pistää Eylea-valmistetta silmääsi aseptisissa (puhtaissa ja steriileissä) olosuhteissa.
Suositeltu annos on 2 mg afliberseptiä (0,05 ml).
Eylea annetaan injektiona silmään (lasiaiseen).
Ennen injisoimista lääkäri puhdistaa silmäsi huolellisesti desinfioivalla silmähuuhtelulla estääkseen tulehduksia. Lääkäri antaa sinulle myös paikallispuudutteen vähentämään tai estämään kipua, joka pistämisestä saattaa aiheutua.
Kostea silmänpohjan ikärappeuma
Potilaat, joilla on kostea silmänpohjan ikärappeuma, saavat yhden injektion kerran kuukaudessa kolmen kuukauden ajan ja sen jälkeen vielä yhden injektion kahden kuukauden kuluttua.
Tämän jälkeen lääkäri päättää pidetäänkö injektion hoitovälinä kaksi kuukautta vai pidennetäänkö hoitoväliä asteittain 2 tai 4 viikon välein, jos tilasi on ollut vakaa. Jos tilasi huononee, hoitoväliä injektioiden välillä voidaan lyhentää.
Ellei sinulla ilmene mitään ongelmia tai lääkäri ei ole toisin ohjeistanut, sinun ei tarvitse tavata lääkäriä injektioiden annon välillä.
Verkkokalvon laskimotukoksesta (haaralaskimotukos tai keskuslaskimotukos) johtava silmänpohjan turvotus
Lääkäri määrittelee sinulle sopivimman hoito-ohjelman. Hoito aloitetaan antamalla sarja Eylea-injektiota kuukauden välein.
Kahden injektion välinen aika ei saa olla lyhyempi kuin yksi kuukausi.
Lääkäri voi lopettaa Eylea-hoidon, jos sen jatkamisesta ei ole hyötyä.
Hoitoa jatketaan kuukauden välein annettavilla injektioilla, kunnes hoitovaste vakiintuu. Voidaan tarvita kolme tai useampia kuukausittain annettavia injektiota.
Lääkäri seuraa hoitovastetta ja pidentää vähitellen hoitoväliä ylläpitäen hoitovastetta. Jos tilanne huononee hoitoväliä pidentämällä, voidaan sitä vastaavasti lyhentää.
Hoitovasteen perusteella lääkäri päättää seurannasta ja hoito-ohjelmasta.
Diabeettinen makulaturvotus
Diabeettista makulaturvotusta sairastavia potilaita hoidetaan yhdellä injektiolla kuukaudessa viidellä peräkkäisellä annoksella, minkä jälkeen annetaan yksi injektio joka toinen kuukausi.
Hoitovälinä voidaan pitää 2 kuukautta tai hoitoväliä voidaan muuttaa tilasi mukaan lääkärisi tutkimusten perusteella. Lääkärisi päättää seurantatutkimusten aikataulusta.
Lääkäri voi päätyä Eylea-hoidon lopettamiseen, jos osoittautuu että hoidon jatkamisesta ei ole hyötyä.
Likitaitteisuuden aiheuttama suonikalvon uudissuonittuminen
Likitaitteisuuden aiheuttamaa suonikalvon uudissuonittumista sairastavat potilaat hoidetaan yhdellä kertainjektiolla. Saat lisäinjektioita vain, jos lääkärin tutkimuksissa havaitaan, että tilassasi ei ole tapahtunut paranemista.
Kahden injektion välisen jakson on oltava vähintään kuukausi.
Jos sairautesi ensin paranee ja sitten uusiutuu, lääkäri saattaa aloittaa hoidon uudelleen.
Lääkäri päättää seurantatutkimusten aikataulusta.
Jos Eylea-annos jää välistä
Sovi uusi aika tutkimukseen ja lääkkeen antamiseen.
Eylea-hoidon lopettaminen
Kysy lääkäriltä neuvoa ennen hoidon lopettamista.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Allergisia reaktioita (yliherkkyyttä) voi esiintyä. Nämä reaktiot voivat olla vakavia. Kerro välittömästi lääkärille, jos sinulla ilmenee tällainen reaktio.
Eylea-valmisteen antamisen yhteydessä voi ilmetä silmiin kohdistuvia, injektiotoimenpiteeseen liittyviä haittavaikutuksia, joista jotkut voivat olla vakavia. Tällaisia haittavaikutuksia ovat muun muassa sokeutuminen, vakava silmänsisäinen tulehdus tai tulehdusreaktio (endoftalmiitti), silmän takaosan valoherkän kerroksen irtoaminen, repeämä tai verenvuoto (verkkokalvon irtauma tai repeämä), linssin samentuminen (kaihi), verenvuoto silmässä (lasiaisverenvuoto), silmän sisällä olevan hyytelömäisen osan irtoaminen verkkokalvosta (lasiaisirtauma) ja silmänpaineen kohoaminen, ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä. Näitä vakavia, silmiin kohdistuvia haittavaikutuksia esiintyi kliinisissä tutkimuksissa harvemmin kuin 1 injektion kohdalla 1 900 injektiosta.
Kerro välittömästi lääkärille, jos sinulla ilmenee äkillistä näkökyvyn heikkenemistä, lisääntynyttä kipua tai punoitusta injektion jälkeen.
Lista raportoiduista haittavaikutuksista
Seuraavassa on lista haittavaikutuksista, joiden on raportoitu mahdollisesti liittyvän injektiotoimenpiteeseen tai lääkkeeseen. Älä kuitenkaan huolestu, sillä sinulla ei mahdollisesti ilmene mitään näistä haittavaikutuksista. Kerro epäillyistä haittavaikutuksista aina lääkärille.
Hyvin yleiset haittavaikutukset (voi ilmetä useammalla kuin yhdellä potilaalla 10:stä)
- näöntarkkuuden huonontuminen
- verenvuoto silmän takaosassa (verkkokalvon verenvuoto)
- verestävä silmä, joka aiheutuu silmän ulommissa kerroksissa sijaitsevien pienten verisuonten verenvuodosta
- silmäkipu
Yleiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 10:stä)
- silmän takaosan jonkun kerroksen irtoaminen tai repeämä, josta aiheutuu valonvälähdyksiä ja lasiaiskellujia ja joka voi joskus johtaa näön menetykseen (verkkokalvon tai sen pigmenttiepiteelin repeämä* tai irtoaminen)
- verkkokalvon rappeuma (aiheuttaen näön häiriintymistä)
- verenvuoto silmässä (lasiaisen verenvuoto)
- tietyt linssin samentumisen muodot (kaihi,
- silmämunan etupinnan vaurioituminen (sarveiskalvo)
- kohonnut silmänpaine
- liikkuvat pisteet näkökentässä (lasiaiskellujat)
- silmän hyytelömäisen osan irtoaminen verkkokalvosta (lasiaisirtauma, josta aiheutuu valonvälähdyksiä ja lasiaiskellujia)
- tunne, että silmässä on jotakin
- lisääntynyt kyynelnesteen eritys
- silmäluomien turvotus
- verenvuoto pistoskohdassa
- silmän punoitus
* Tiloja, joiden tiedetään liittyvän kosteaan silmänpohjan ikärappeumaan; havaittu kosteaa silmänpohjan ikärappeumaa sairastavilla potilailla.
Melko harvinaiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 100:sta):
- allergiset reaktiot (yliherkkyys) **
- vakava silmänsisäinen tulehdus tai tulehdusreaktio (endoftalmiitti)
- tulehdus silmän värikalvossa tai muissa silmän osissa (iriitti, uveiitti, iridosykliitti, etukammion punoitus)
- poikkeava tunne silmässä
- silmäluomen ärsytys
- silmämunan etupinnan turvotus (sarveiskalvon turvotus)
- ** allergiset reaktiot kuten ihottuma, kutina, nokkosrokko (urtikaria). Muutamia yksittäisiä vakavia allergisia reaktioita anafylaktinen/anafylaktoidinen) on raportoitu.
Harvinaiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 1000:sta)
- sokeutuminen
- vamman aiheuttama linssin samentuminen (traumaperäinen kaihi)
- silmän silmän hyytelömäisen osan tulehdus
- märkää silmässä
Kliinisissä tutkimuksissa todettiin verenvuodon esiintyvyyden lisääntymistä pienistä verisuonista
silmän uloimmissa kerroksissa (sidekalvon verenvuoto) kosteaa silmänpohjan ikärappeumaa sairastavilla potilailla, jotka käyttivät verenohennuslääkkeitä. Tätä havaittiin yhtä paljon potilailla, joita hoidettiin ranibitsumabilla ja Eylea-valmisteella.
Verisuonikasvutekijän estäjien, kuten Eylea-valmisteen vaikuttavan aineen, systemaattiseen käyttöön voi liittyä verisuonia tukkivien verihyytymien (valtimotukos) riski. Tällaiset tapahtumat voivat aiheuttaa sydäninfarktin tai aivohalvauksen. On olemassa teoreettinen riski, että Eylea-valmisteen injektointi silmään aiheuttaa tällaisen tapahtuman.
Kuten kaikki terapeuttisen proteiinit, myös Eylea-valmiste saattaa aiheuttaa immuunireaktion (vasta-aineiden muodostuminen).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä pakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä jääkaapissa (2 °C – 8 °C). Ei saa jäätyä.
- Avaamaton injektiopullo voidaan säilyttää poissa jääkaapista alle 25 °C:ssa enintään 24 tunnin ajan.
- Säilytä alkuperäispakkauksessa. Herkkä valolle.
- Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Eylea sisältää
- Vaikuttava aine on aflibersepti. Yhden injektiopullon sisältämä kokonaismäärä on vähintään 0,1 ml, mikä vastaa vähintään 4 mg:aa afliberseptiä. Yhdestä injektiopullosta saadaan 2 mg:n afliberseptiannos 0,05 millilitrassa.
- Muut aineet ovat: polysorbaatti 20 (E 432), natriumdivetyfosfaattimonohydraatti (pH:n säätöön), dinatriumvetyfosfaattiheptahydraatti (pH:n säätöön), natriumkloridi, sakkaroosi, injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Eylea on injektioneste, liuos, (injektio) injektiopullossa. Liuos on väritön tai vaaleankeltainen.
Pakkauskoko on 1injektiopullo + 1 suodatinneula.
Myyntiluvan haltija
Bayer AG
51368 Leverkusen
Saksa
Valmistaja
Bayer AG
Müllerstraße 178
13353 Berlin
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja
Bayer Oy
Puh/Tel: +358-(0)20-78521
Tämä pakkausseloste on tarkistettu viimeksi 03/2024
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta http://www.ema.europa.eu/.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattiaisillle:
Injektiopullo tulisi käyttää vain yhden silmän hoitamiseen.
Injektiopullo sisältää enemmän kuin suositellun 2 mg:n afliberseptiannoksen (vastaa 0,05 ml:aa injektionestettä). Ylimäärä on poistettava ennen antoa.
Ennen lääkkeen antamista, liuos on tarkastettava silmämääräisesti mahdollisten hiukkasten ja/tai värimuutosten ja/tai minkä tahansa valmisteen fysikaalisen ulkonäön muutoksen havaitsemiseksi. Mikäli tällaista havaitaan, tulee lääkevalmiste hävittää.
Avaamaton injektiopullo voidaan säilyttää poissa jääkaapista alle 25 °C:ssa enintään 24 tunnin ajan. Injektiopullon avaamisen jälkeen on jatkettava aseptisissa olosuhteissa.
Lasiaiseen annettavaan injektioon on käytettävä 30 G x ½ tuuman kokoista injektioneulaa
Injektiopullon käyttö ohjeet:
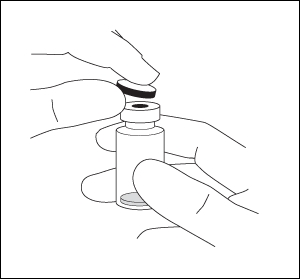
1. Poista muovikorkki ja desinfioi injektiopullon kumitulpan ulkopuoli.
2. Liitä pakkauksessa tuleva 18 G:n, mikronin suodatinneula 1 ml :n steriiliin Luer-lock-ruiskuun.
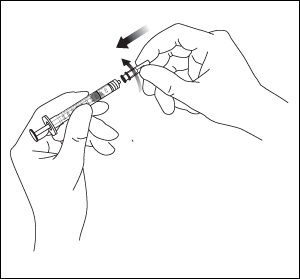
3. Työnnä suodatinneulaa injektiopullon tulpan keskiosaan, kunnes neula on kokonaan työntynyt injektiopulloon ja kärki koskee injektiopullon pohjaan tai pohjan reunaan.
4. Käytä aseptista tekniikkaa ja vedä Eylea-injektiopullon koko sisältö ruiskuun samalla, kun pidät injektiopulloa pystysuorassa ja hieman kallistetussa asennossa. Tämä asento helpottaa koko sisällön vetämistä ruiskuun. Estääksesi ilman pääsyn ruiskuun, varmista että suodatinneulan kärki on nesteen pinnan alla. Pidä pullo kallellaan, kun vedät nestettä ruiskuun, niin että suodatinneulan kärki on nesteen pinnan alapuolella.
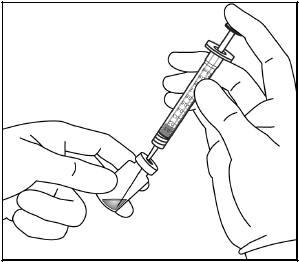
5. Varmista, että männän tanko on vedetty tarpeeksi taakse, kun tyhjennät injektiopulloa. Näin suodatinneula tyhjenee varmasti kokonaan.
6. Poista suodatinneula ja hävitä se asianmukaisesti.
Huomautus: suodatinneulaa ei saa käyttää lasiaisinjektioon.
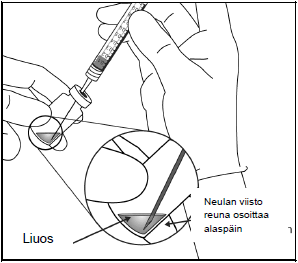
7.Käytä aseptista tekniikkaa ja kiinnitä 30 G:n x ½ tuuman injektioneula tiukasti Luer-lock-ruiskun kärkeen.
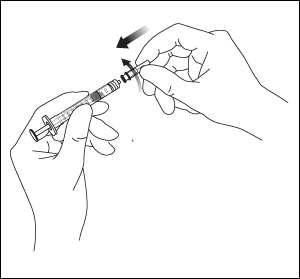
8. Pidä ruiskua niin, että neula osoittaa ylöspäin, ja tarkista ruisku kuplien varalta. Jos ruiskussa näkyy kuplia, naputa ruiskua varovasti sormella, kunnes kuplat nousevat pinnalle.
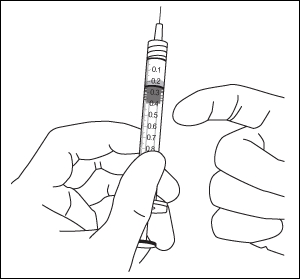
9. Poista kaikki kuplat ja liiallinen lääke painamalla mäntää hitaasti niin, että männän litteä reuna kohdistuu ruiskussa olevaan 0,05 ml:n annosviivaan.
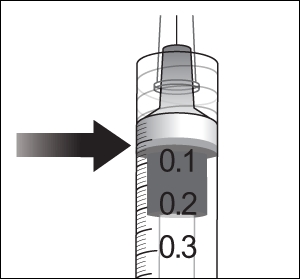
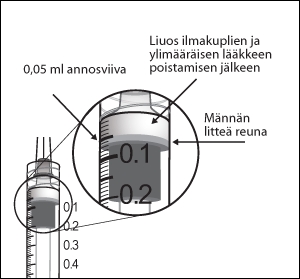
10. Injektiopullot on tarkoitettu vain kertakäyttöön. Useiden annosten ottaminen yhdestä injektiopullosta voi lisätä kontaminaation riskiä ja sen seurauksena infektion riskiä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.