Eylea 40 mg/ml injektioneste, liuos, esitäytetyssä ruiskussa
aflibersepti
Yleisiä ohjeita
Pakkausseloste: Tietoa aikuispotilaalle
Pakkausseloste: Tietoa ennenaikaisesti syntyneiden vauvojen huoltajille
AIKUISET
Lue tämä pakkausseloste huolellisesti ennen kuin saat tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
ENNENAIKAISESTI SYNTYNEET VAUVAT
Lue tämä pakkausseloste huolellisesti ennen kuin vauva saa tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny vauvan lääkärin puoleen.
- Jos havaitset haittavaikutuksiin viittaavia oireita, kerro niistä vauvan lääkärille. Tämä koskee myös sellaisia mahdollisia oireita ja haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
AIKUISET
1. Mitä Eylea on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat Eylea-valmistetta
3. Miten Eylea-valmistetta annetaan
4. Mahdolliset haittavaikutukset
5. Eylea-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
ENNENAIKAISESTI SYNTYNEET VAUVAT
Tässä pakkausselosteessa kerrotaan:
1. Mitä Eylea on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin vauva saa Eylea-valmistetta
3. Miten Eylea-valmistetta annetaan vauvalle
4. Mahdolliset haittavaikutukset
5. Eylea-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
AIKUISET
Eylea on liuos, joka annetaan injektiona silmään. Sillä hoidetaan aikuisten silmäsairauksia nimeltä
- kostea silmänpohjan ikärappeuma, johon liittyy verisuonten uudismuodostusta silmässä
- näkökyvyn heikkeneminen, joka johtuu verkkokalvon laskimotukoksen (haaralaskimotukos (BRVO) tai keskuslaskimotukos (CRVO)) aiheuttamasta silmänpohjan turvotuksesta
- näkökyvyn heikkeneminen, joka johtuu diabeettisesta makulaturvotuksesta
- näkökyvyn heikkeneminen, joka johtuu likitaitteisuuden aiheuttamasta suonikalvon uudissuonittumisesta (myooppinen CNV).
Aflibersepti, Eylea-valmisteen aktiivinen aine, estää verisuonikasvutekijöiden VEGF-A:n (verisuoniston endoteelin kasvutekijä A) ja PIGF:n (plasentaalinen kasvutekijä) toimintaa.
Kosteaa silmänpohjan ikärappeumaa ja likitaitteisuuden aiheuttamaa suonikalvon uudissuonittumista sairastavilla potilailla näiden tekijöiden liiallinen toiminta aiheuttavat epänormaalien uusien verisuonien muodostumisen silmässä. Nämä uudet poikkeavat verisuonet voivat aiheuttaa veren aineosien vuotamista silmään ja ajan myötä vahingoittaa näkökyvystä vastaavia silmän kudoksia.
Potilailla, joilla on verkkokalvon keskuslaskimotukos, on tukos tärkeimmässä verta verkkokalvosta poispäin kuljettavassa verisuonessa. Verisuonikasvutekijöiden tasot ovat koholla, jolloin nestettä vuotaa verkkokalvoon. Tämä aiheuttaa makulan (verkkokalvon tarkkaan näkemiseen liittyvä osa) turpoamisen eli makulaarisen edeeman. Jos makulassa on turvotusta ja nestettä, keskeinen näkö sumenee.
Potilailla, joilla on verkkokalvon haaralaskimotukos, on tukos yhdessä tai useammassa tärkeimmän verta verkkokalvosta poispäin kuljettavan verisuonen haarassa. Verisuonikasvutekijöiden tasot ovat koholla, jolloin nestettä vuotaa verkkokalvoon. Tämä aiheuttaa makulan turpoamisen eli makulaarisen edeeman.
Diabeettinen makulaturvotus on verkkokalvon turvotus, jota esiintyy diabetesta sairastavilla potilailla ja joka johtuu makulan verisuonista vuotavasta nesteestä. Makula on verkkokalvon tarkkaan näkemiseen liittyvä alue. Jos makulassa on turvotusta ja nestettä, keskeinen näkö sumenee.
Eylea-valmisteen on osoitettu pysäyttävän uusien epänormaalien, usein nestettä tai verta vuotavien verisuonten kasvun silmässä. Eylea voi auttaa vakauttamaan ja monissa tapauksissa parantamaan silmänpohjan kosteaan ikärappeumaan, verkkokalvon keskuslaskimotukokseen, haaralaskimotukokseen, diabeettiseen makulaturvotukseen ja likitaitteisuuden aiheuttamaan suonikalvon uudissuonittumiseen liittyvää näönmenetystä.
ENNENAIKAISESTI SYNTYNEET VAUVAT
Eylea on liuos, joka annetaan injektiona silmään. Eylea kuuluu verisuonten uudismuodostusta estävien lääkkeiden ryhmään. Sen vaikuttava aine on aflibersepti.
Eylea-valmistetta käytetään ennenaikaisesti syntyneille vauvoille keskosen retinopatiaksi (ROP) kutsutun silmäsairauden hoitoon. Keskosen retinopatiaa sairastavilla vauvoilla silmän verkkokalvolle alkaa kasvaa uusia ja epänormaaleja verisuonia verisuonikasvutekijän (VEGF) vaikutuksesta. Tämä voi aiheuttaa näön heikentymistä ja vaikeissa tapauksessa pysyvän sokeutumisen.
Aflibersepti, Eylea-valmisteen aktiivinen aine, estää verisuonikasvutekijöiden VEGF-A:n (verisuoniston endoteelin kasvutekijä A) ja PIGF:n (plasentaalinen kasvutekijä) toimintaa.
Eylea-valmisteen on osoitettu pysäyttävän uusien epänormaalien, usein nestettä tai verta vuotavien verisuonten kasvun silmässä. Eylea voi auttaa vakauttamaan ja monissa tapauksissa parantamaan keskosen retinopatiaan liittyvää näönmenetystä.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
AIKUISET
Sinulle EI anneta Eylea-valmistetta
- jos olet allerginen afliberseptille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on aktiivinen tai epäilty tulehdus silmässä tai sen ympärillä (silmä- tai silmänympärysinfektio)
- jos sinulla on vakava tulehdusreaktio silmässä (oireena kipu tai punoitus).
Varoitukset ja varotoimet
Keskustele lääkärin kanssa, ennen kuin sinulle annetaan Eylea-valmistetta:
- jos sinulla on silmänpainetauti (glaukooma).
- jos olet aiemmin nähnyt valonvälähdyksiä tai näkökentässä leijuvia läpinäkyviä kuvioita ja jos kuvioiden koko tai määrä äkillisesti lisääntyy.
- jos sinulle on suoritettu tai suunnitellaan suorittavaksi silmäleikkaus edeltävän tai seuraavan neljän viikon aikana.
- jos sinulla on verkkokalvon keskus- tai haaralaskimotukoksen vakava muoto (iskeeminen verkkokalvon keskus- tai haaralaskimotukos), Eylea-hoitoa ei suositella.
Lisäksi on tärkeää tietää, että:
- molempiin silmiin samanaikaisesti annetun Eylea-valmisteen turvallisuutta ja tehoa ei ole tutkittu ja samanaikaisesti käytettynä voi johtaa haittavaikutusten esiintymisen riskin kasvuun.
- Eylea-injektio voi joillakin potilailla aiheuttaa silmänpaineen (intraokulaarisen paineen) kohoamisen 60 minuutin sisällä ruiskutuksesta. Lääkäri seuraa tätä kunkin ruiskutuksen jälkeen.
- jos sinulle kehittyy silmän sisäosan tulehdus tai tulehdusreaktio (endoftalmiitti) tai saat muita komplikaatioita, sinulla voi ilmetä silmäkipua tai lisääntynyttä epämukavuuden tunnetta silmässä, silmän punoituksen pahenemista, näön sumenemista tai heikkenemistä sekä valoherkkyyden lisääntymistä. On tärkeää, että kaikki oireet diagnosoidaan ja hoidetaan mahdollisimman nopeasti.
- lääkäri tarkistaa, onko sinulla muita riskitekijöitä, jotka voivat lisätä todennäköisyyttä silmän takaosan kerroksien repeämään tai irtoamiseen (verkkokalvon tai sen pigmenttiepiteelin irtoaminen tai repeämä). Tällöin Eylea-valmistetta tulee antaa varoen.
- Eylea-valmistetta ei pidä käyttää raskauden aikana, ellei hoidon mahdollinen hyöty ole sikiölle aiheutuvaa mahdollista riskiä suurempi.
- naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana sekä vähintään kolme kuukautta viimeisen Eylea-injektion jälkeen.
Verisuonikasvutekijän estäjien, kuten Eylea-valmisteen vaikuttavan aineen, systemaattiseen käyttöön voi liittyä verisuonia tukkivien verihyytymien (valtimotukos) riski, mikä puolestaan voi johtaa sydänkohtaukseen tai aivohalvaukseen. Tämä on teoriassa mahdollista Eylea-valmisteen silmänsisäisen annostelun jälkeen. Sellaisten potilaiden hoidon turvallisuudesta, joilla on verkkokalvon keskuslaskimotukos, haaralaskimotukos, diabeettinen makulaturvotus ja likitaitteisuuden aiheuttama suonikalvon uudissuonittuminen ja on ollut aivohalvaus tai ohimenevä aivoverenkiertohäiriö edellisen 6 kuukauden aikana, on saatavana rajallisesti tietoa. Jos jokin näistä koskee sinua, Eylea-valmistetta annetaan varoen.
Seuraavien tapausten hoidosta on vain rajallisesti kokemusta:
- potilaat, joilla on tyypin 1 diabeteksesta johtuva diabeettinen makulaturvotus.
- diabeetikot, joiden verensokeriarvo on hyvin korkea (HbA1c yli 12 %).
- diabeetikot, joilla on diabeteksesta johtuva proliferatiivinen diabeettinen retinopatia.
Seuraavien tapausten hoidosta ei ole kokemusta:
- potilaat, joilla on akuutteja infektioita.
- potilaat, joilla on muita silmäsairauksia, kuten verkkokalvon irtoaminen tai makulareikä.
- diabeetikot, joiden korkea verenpaine ei ole hoitotasapainossa.
- muut kuin aasialaista syntyperää olevat potilaat, joilla on likitaitteisuuden aiheuttama suonikalvon uudissuonittuminen.
- potilaat, jotka ovat aiemmin saaneet hoitoa likitaitteisuuden aiheuttamaan suonikalvon uudissuonittumiseen.
- likitaitteisuuden aiheuttaman suonikalvon uudissuonittumisen hoito potilailla, joilla on vaurioita makulan keskiosan ulkopuolella (ekstrafoveaalisia leesioita).
Jos jokin näistä koskee sinua, lääkärisi ottaa tämän tietojen puutteellisuuden huomioon hoitaessasi sinua Eylea-valmisteella.
Lapset ja nuoret
Eylea-valmisteen käyttöä alle 18-vuotiaille lapsille ja nuorille ei ole tutkittu muihin käyttöaiheisiin kuin keskosen retinopatiaan (ROP)
Muut lääkevalmisteet ja Eylea
Kerro lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
- Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana sekä vähintään kolme kuukautta viimeisen Eylea-injektion jälkeen.
- Eylea-valmisteen käytöstä raskaana oleville naisille ei ole kokemuksia. Eylea-valmistetta ei pidä käyttää raskauden aikana, ellei mahdollinen hyöty ole syntymättömälle lapselle aiheutuvaa mahdollista riskiä suurempi. Jos olet raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen Eylea-hoidon saamista.
- Pieniä määriä Eylea-valmistetta voi erittyä ihmisen äidinmaitoon. Vaikutuksia imetettäviin vauvoihin ei tunneta. Eylea-valmistetta ei suositella käytettäväksi imetyksen aikana. Jos imetät, keskustele asiasta lääkärin kanssa ennen Eylea-valmisteen käyttämistä.
Ajaminen ja koneiden käyttö
Eylea-injektion jälkeen sinulla voi ilmetä joitakin väliaikaisia näköhäiriöitä. Älä aja tai käytä koneita, kun näkösi ei ole normaali.
ENNENAIKAISESTI SYNTYNEET VAUVAT
2. Mitä sinun on tiedettävä, ennen kuin vauva saa Eylea-valmistetta
Vauvalle EI anneta Eylea-valmistetta
- jos hän on allerginen afliberseptille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos hänellä on aktiivinen tai epäilty tulehdus silmässä tai sen ympärillä (silmä- tai silmänympärysinfektio)
- jos hänellä on vakava tulehdusreaktio silmässä (oireena kipu tai punoitus).
Varoitukset ja varotoimet
Keskustele vauvan lääkärin kanssa, ennen kuin vauvalle annetaan Eylea-valmistetta:
- jos vauvalle on suoritettu tai suunnitellaan suorittavaksi silmäleikkaus edeltävän tai seuraavan neljän viikon aikana.
Lisäksi on tärkeää tietää, että:
- Eylea-injektio voi joillakin potilailla aiheuttaa silmänpaineen (intraokulaarisen paineen) kohoamisen 60 minuutin sisällä ruiskutuksesta. Vauvan lääkäri seuraa tätä kunkin ruiskutuksen jälkeen.
- jos vauvalle kehittyy silmän sisäosan tulehdus tai tulehdusreaktio (endoftalmiitti) tai muita komplikaatioita, vauvalla voi ilmetä silmän punoitusta/ärsytystä, silmäeritettä, silmäluomen turvotusta sekä valoherkkyyden lisääntymistä. On tärkeää, että kaikki oireet diagnosoidaan ja hoidetaan mahdollisimman nopeasti.
Kerro vauvan lääkärille välittömästi, jos vauvalle kehittyy mitä tahansa edellä mainituista merkeistä tai oireista.
- vauvan lääkäri tarkistaa, onko vauvalla muita riskitekijöitä, jotka voivat lisätä todennäköisyyttä silmän takaosan kerroksien repeämään tai irtoamiseen (verkkokalvon irtoaminen tai repeämä). Tällöin Eylea-valmistetta tulee antaa varoen.
Verisuonikasvutekijän estäjien, kuten Eylea-valmisteen vaikuttavan aineen, systemaattiseen käyttöön voi liittyä verisuonia tukkivien verihyytymien (valtimotukos) riski, mikä puolestaan voi johtaa sydänkohtaukseen tai aivohalvaukseen. Tämä on teoriassa mahdollista Eylea-valmisteen silmänsisäisen annostelun jälkeen.
Seuraavien tapausten hoidosta ei ole kokemusta:
- potilaat, joilla on akuutteja infektioita.
- potilaat, joilla on muita silmäsairauksia, kuten verkkokalvon irtoaminen tai makulareikä.
Jos jokin näistä koskee vauvaa, vauvan lääkäri ottaa tämän tietojen puutteellisuuden huomioon hoitaessasi vauvaa Eylea-valmisteella.
Muut lääkevalmisteet ja Eylea
Kerro vauvan lääkärille, jos vauva parhaillaan saa, on äskettäin saanut tai saattaa saada muita lääkkeitä.
Tärkeää tietoa Eylea-valmisteen sisältämistä aineista
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per annos eli sen voidaan sanoa olevan ”natriumiton”.
3. Miten valmistetta käytetään
AIKUISET
Lääkäri, jolla on kokemusta lääkeinjektioiden antamisesta silmään, pistää Eylea-valmistetta silmääsi aseptisissa (puhtaissa ja steriileissä) olosuhteissa.
Suositeltu annos on 2 mg afliberseptiä (0,05 ml ).
Eylea annetaan injektiona silmään (lasiaiseen).
Ennen injisoimista lääkäri puhdistaa silmäsi huolellisesti desinfioivalla silmähuuhtelulla estääkseen tulehduksia. Lääkäri antaa sinulle myös paikallispuudutteen vähentämään tai estämään kipua, joka pistämisestä saattaa aiheutua.
Kostea silmänpohjan ikärappeuma
Potilaat, joilla on kostea silmänpohjan ikärappeuma, saavat yhden injektion kerran kuukaudessa kolmen kuukauden ajan ja sen jälkeen vielä yhden injektion kahden kuukauden kuluttua.
Tämän jälkeen lääkäri päättää pidetäänkö injektion hoitovälinä kaksi kuukautta vai pidennetäänkö hoitoväliä asteittain 2 tai 4 viikon jaksoissa, jos tilasi on ollut vakaa. Jos tilasi huononee, hoitoväliä injektioiden välillä voidaan lyhentää.
Ellei sinulla ilmene mitään ongelmia tai lääkäri ei ole toisin ohjeistanut, sinun ei tarvitse tavata lääkäriä injektioiden annon välillä.
Verkkokalvon laskimotukoksesta (haaralaskimotukos tai keskuslaskimotukos) johtuva silmänpohjan turvotus
Lääkäri määrittelee sinulle sopivimman hoito-ohjelman. Hoito aloitetaan antamalla sarja Eylea-injektioita kuukauden välein.
Kahden injektion välinen aika ei saa olla lyhyempi kuin yksi kuukausi.
Lääkäri voi lopettaa Eylea-hoidon, jos sen jatkamisesta ei ole hyötyä.
Hoitoa jatketaan kuukauden välein annettavilla injektioilla, kunnes hoitovaste vakiintuu. Voidaan tarvita kolme tai useampia kuukausittain annettavia injektiota.
Lääkäri seuraa hoitovastetta ja pidentää vähitellen hoitoväliä ylläpitäen hoitovastetta. Jos tilanne huononee hoitoväliä pidentämällä, voidaan sitä vastaavasti lyhentää.
Hoitovasteen perusteella lääkäri päättää seurannasta ja hoito-ohjelmasta.
Diabeettinen makulaturvotus
Diabeettista makulaturvotusta sairastavia potilaita hoidetaan yhdellä injektiolla kuukaudessa viidellä peräkkäisellä annoksella, minkä jälkeen annetaan yksi injektio joka toinen kuukausi.
Hoitovälinä voidaan pitää 2 kuukautta tai hoitoväliä voidaan muuttaa tilasi mukaan lääkärisi tutkimusten perusteella. Lääkärisi päättää seurantatutkimusten aikataulusta.
Lääkäri voi päätyä Eylea-hoidon lopettamiseen, jos osoittautuu että hoidon jatkamisesta ei ole hyötyä.
Likitaitteisuuden aiheuttama suonikalvon uudissuonittuminen
Likitaitteisuuden aiheuttamaa suonikalvon uudissuonittumista sairastavat potilaat hoidetaan yhdellä kertainjektiolla. Saat lisäinjektioita vain, jos lääkärin tutkimuksissa havaitaan, että tilassasi ei ole tapahtunut paranemista.
Kahden injektion välisen jakson on oltava vähintään kuukausi.
Jos sairautesi ensin paranee ja sitten uusiutuu, lääkäri saattaa aloittaa hoidon uudelleen.
Lääkäri päättää seurantatutkimusten aikataulusta.
Yksityiskohtaiset käyttöohjeet annetaan pakkausselosteen lopussa kohdassa ”Eylea-valmisteen valmistelu ja anto aikuisille”.
Jos Eylea-annos jää välistä
Sovi uusi aika tutkimukseen ja lääkkeen antamiseen.
Eylea-hoidon lopettaminen
Kysy lääkäriltä neuvoa ennen hoidon lopettamista.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
ENNENAIKAISESTI SYNTYNEET VAUVAT
3. Miten Eylea-valmistetta annetaan vauvalle
Lääkäri, jolla on kokemusta lääkeinjektioiden antamisesta silmään, pistää Eylea-valmistetta vauvan silmiin aseptisissa (puhtaissa ja steriileissä) olosuhteissa.
Suositeltu annos on 0,4 mg afliberseptiä (0,01 ml).
Eylea annetaan injektiona vauvan silmään (lasiaiseen).
Ennen injisoimista vauvan lääkäri puhdistaa vauvan silmän huolellisesti desinfioivalla silmähuuhtelulla estääkseen tulehduksia. Vauvan lääkäri antaa vauvalle myös paikallispuudutteen vähentämään tai estämään kipua, joka pistämisestä saattaa aiheutua.
Hoito aloitetaan antamalla yksi pistos silmää kohti, ja molemmat silmät voidaan hoitaa samana päivänä. Vauvan lääkäri seuraa vauvan silmän/silmien tilaa. Vauvan lääkäri päättää jatkohoidon tarpeesta ja ajankohdasta hoitovasteen perusteella. Kahden samaan silmään pistettävän annoksen välillä on pidettävä vähintään neljän viikon hoitoväli.
Yksityiskohtaiset käyttöohjeet annetaan pakkausselosteen lopussa kohdassa ”Eylea-valmisteen valmistelu ja anto keskosille”.
Eylea-hoidon lopettaminen
Jos harkitset vauvan Eylea-hoidon lopettamista, keskustele asiasta vauvan lääkärin kanssa seuraavalla vastaanottokäynnillä. Vauvan lääkäri neuvoo sinua ja päättää, miten pitkään vauvan Eylea-hoitoa pitää jatkaa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny vauvan lääkärin puoleen.
4. Mahdolliset haittavaikutukset
AIKUISET
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Allergisia reaktioita (yliherkkyyttä) voi esiintyä. Nämä reaktiot voivat olla vakavia. Kerro välittömästi lääkärille, jos sinulla ilmenee tällainen reaktio.
Eylea-valmisteen antamisen yhteydessä voi ilmetä silmiin kohdistuvia, injektiotoimenpiteeseen liittyviä haittavaikutuksia, joista jotkut voivat olla vakavia. Tällaisia haittavaikutuksia ovat muun muassa sokeutuminen, vakava silmänsisäinen tulehdus tai tulehdusreaktio (endoftalmiitti), silmän takaosan valoherkän kerroksen irtoaminen, repeämä tai verenvuoto (verkkokalvon irtauma tai repeämä), linssin samentuminen (kaihi), verenvuoto silmässä (lasiaisverenvuoto), silmän sisällä olevan hyytelömäisen osan irtoaminen verkkokalvosta (lasiaisirtauma) ja silmänpaineen kohoaminen, ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä. Näitä vakavia, silmiin kohdistuvia haittavaikutuksia esiintyi kliinisissä tutkimuksissa harvemmin kuin 1 injektion kohdalla 1 900 injektiosta.
Kerro välittömästi lääkärille, jos sinulla ilmenee äkillistä näkökyvyn heikkenemistä, lisääntynyttä kipua tai punoitusta injektion jälkeen.
Lista raportoiduista haittavaikutuksista
Seuraavassa on lista haittavaikutuksista, joiden on raportoitu mahdollisesti liittyvän injektiotoimenpiteeseen tai lääkkeeseen. Älä kuitenkaan huolestu, sillä sinulla ei mahdollisesti ilmene mitään näistä haittavaikutuksista. Kerro epäillyistä haittavaikutuksista aina lääkärille.
Hyvin yleiset haittavaikutukset (voi ilmetä useammalla kuin yhdellä potilaalla 10:stä)
- näöntarkkuuden huonontuminen
- verenvuoto silmän takaosassa (verkkokalvon verenvuoto)
- verestävä silmä, joka aiheutuu silmän ulommissa kerroksissa sijaitsevien pienten verisuonten verenvuodosta
- silmäkipu
Yleiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 10:stä)
- silmän takaosan jonkun kerroksen irtoaminen tai repeämä, josta aiheutuu valonvälähdyksiä ja lasiaiskellujia ja joka voi joskus johtaa näön menetykseen (verkkokalvon tai sen pigmenttiepiteelin repeämä* tai irtoaminen)
- *Tiloja, joiden tiedetään liittyvän kosteaan silmänpohjan ikärappeumaan; havaittu kosteaa silmänpohjan ikärappeumaa sairastavilla potilailla.
- verkkokalvon rappeuma joka aiheuttaa ( näön häiriintymistä)
- verenvuoto silmässä (lasiaisen verenvuoto)
- tietyt linssin samentumisen muodot (kaihi)
- silmämunan etupinnan vaurioituminen (sarveiskalvo)
- kohonnut silmänpaine
- liikkuvat pisteet näkökentässä (lasiaiskellujat)
- silmän hyytelömäisen osan irtoaminen verkkokalvosta (lasiaisirtauma, josta aiheutuu valonvälähdyksiä ja lasiaiskellujia)
- tunne, että silmässä on jotakin
- lisääntynyt kyynelnesteen eritys
- silmäluomien turvotus
- verenvuoto pistoskohdassa
- silmän punoitus
Melko harvinaiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 100:sta):
- allergiset reaktiot (yliherkkyys)**
- **Allergiset reaktiot kuten ihottuma, kutina, nokkosrokko (urtikaria). Muutamia yksittäisiä vakavia allergisia reaktioita (anafylaktinen/anafylaktoidinen) on raportoitu.
- vakava silmänsisäinen tulehdus tai tulehdusreaktio (endoftalmiitti)
- tulehdus silmän värikalvossa tai muissa silmän osissa (iriitti, uveiitti, iridosykliitti, etukammion punoitus)
- poikkeava tunne silmässä
- silmäluomen ärsytys
- silmämunan etupinnan turvotus (sarveiskalvon turvotus).
Harvinaiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 1000:sta)
- sokeutuminen
- vamman aiheuttama linssin samentuminen (traumaperäinen kaihi)
- silmän hyytelömäisen osan tulehdus
- märkää silmässä.
Kliinisissä tutkimuksissa todettiin verenvuodon esiintyvyyden lisääntymistä pienistä verisuonista silmän uloimmissa kerroksissa (sidekalvon verenvuoto) kosteaa silmänpohjan ikärappeumaa sairastavilla potilailla, jotka käyttivät verenohennuslääkkeitä. Tätä havaittiin yhtä paljon potilailla, joita hoidettiin ranibitsumabilla ja Eylea-valmisteella.
Verisuonikasvutekijän estäjien, kuten Eylea-valmisteen vaikuttavan aineen, systemaattiseen käyttöön voi liittyä verisuonia tukkivien verihyytymien (valtimotukos) riski. Tällaiset tapahtumat voivat aiheuttaa sydäninfarktin tai aivohalvauksen. On olemassa teoreettinen riski, että Eylea-valmisteen injektointi silmään aiheuttaa tällaisen tapahtuman.
Kuten kaikki terapeuttiset proteiinit, myös Eylea-valmiste saattaa aiheuttaa immuunireaktion (vasta-aineiden muodostuminen).
ENNENAIKAISESTI SYNTYNEET VAUVAT
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on ilmoitettu useammalla kuin yhdellä ennenaikaisesti syntyneellä vauvalla
- silmän takaosassa sijaitsevan kerroksen irtoaminen (verkkokalvon irtauma)
- silmän takaosan verenvuoto (verkkokalvon verenvuoto)
- silmän verestys, joka johtuu silmän uloimpien kerrosten pienten verisuonten verenvuodosta (sidekalvon verenvuoto)
- pistoskohdan verenvuoto (injektiokohdan verenvuoto)
- silmänpaineen kohoaminen
- silmäluomen turvotus (silmäluomen edeema)
Muut haittavaikutukset, joita on todettu Eylea-hoitoa saaneilla aikuisilla, on lueteltu alla. Näitä haittavaikutuksia voi esiintyä myös ennenaikaisesti syntyneillä vauvoilla
- allergiset reaktiot (yliherkkyys)
Nämä reaktiot voivat olla vakavia. Kerro välittömästi vauvan lääkärille, jos vauvalla ilmenee tällainen reaktio.
Silmiin kohdistuvat, injektiotoimenpiteeseen liittyvät haittavaikutukset voivat olla vakavia. Tällaisia haittavaikutuksia ovat muun muassa
- sokeutuminen
- vakava silmänsisäinen tulehdus tai tulehdusreaktio (endoftalmiitti)
- silmän takaosan valoherkän kerroksen irtoaminen, repeämä tai verenvuoto (verkkokalvon irtauma tai repeämä)
- linssin samentuminen (kaihi)
- verenvuoto silmässä (lasiaisverenvuoto)
- silmän sisällä olevan hyytelömäisen osan irtoaminen verkkokalvosta (lasiaisirtauma)
- silmänpaineen kohoaminen, ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä
Näitä vakavia, silmiin kohdistuvia haittavaikutuksia esiintyi aikuisilla tehdyissä kliinisissä tutkimuksissa harvemmin kuin 1 injektion kohdalla 1 900 injektiosta.
On tärkeää, että vakavat haittavaikutukset, kuten silmänsisäinen tulehdus tai verkkokalvon irtauma, tunnistetaan ja hoidetaan mahdollisimman nopeasti.
Kerro välittömästi vauvan lääkärille, jos havaitset vauvalla silmäoireita injektion jälkeen. Niitä voivat olla muun muassa
- punoitus/ärsytys
- silmäerite
- silmäluomen turvotus
- valoherkkyyden lisääntyminen
Muut aikuisilla todetut haittavaikutukset on kuvattu alla.
Lista raportoiduista haittavaikutuksista
Seuraavassa on lista haittavaikutuksista, joiden on raportoitu mahdollisesti liittyvän injektiotoimenpiteeseen tai lääkkeeseen. Älä kuitenkaan huolestu, sillä vauvalla ei mahdollisesti ilmene mitään näistä haittavaikutuksista. Kerro epäillyistä haittavaikutuksista aina vauvan lääkärille.
Hyvin yleiset haittavaikutukset (voi ilmetä useammalla kuin yhdellä potilaalla 10:stä)
- näöntarkkuuden huonontuminen
- verenvuoto silmän takaosassa (verkkokalvon verenvuoto)
- verestävä silmä, joka aiheutuu silmän ulommissa kerroksissa sijaitsevien pienten verisuonten verenvuodosta
- silmäkipu
Yleiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 10:stä)
- silmän takaosan jonkun kerroksen irtoaminen tai repeämä, josta aiheutuu valonvälähdyksiä ja lasiaiskellujia ja joka voi joskus johtaa näön menetykseen (verkkokalvon tai sen pigmenttiepiteelin repeämä* tai irtoaminen)
- * Tiloja, joiden tiedetään liittyvän kosteaan silmänpohjan ikärappeumaan; havaittu kosteaa silmänpohjan ikärappeumaa sairastavilla potilailla.
- verkkokalvon rappeuma, joka aiheuttaa näön häiriintymistä
- verenvuoto silmässä (lasiaisen verenvuoto)
- tietyt linssin samentumisen muodot (kaihi)
- silmämunan etupinnan vaurioituminen (sarveiskalvo)
- kohonnut silmänpaine
- liikkuvat pisteet näkökentässä (lasiaiskellujat)
- silmän hyytelömäisen osan irtoaminen verkkokalvosta (lasiaisirtauma, josta aiheutuu valonvälähdyksiä ja lasiaiskellujia)
- tunne, että silmässä on jotakin
- lisääntynyt kyynelnesteen eritys
- silmäluomien turvotus
- verenvuoto pistoskohdassa
- silmän punoitus
Melko harvinaiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 100:sta):
- allergiset reaktiot (yliherkkyys)**
- ** Allergiset reaktiot kuten ihottuma, kutina, nokkosrokko (urtikaria). Muutamia yksittäisiä vakavia allergisia reaktioita (anafylaktinen/anafylaktoidinen) on raportoitu.
- vakava silmänsisäinen tulehdus tai tulehdusreaktio (endoftalmiitti)
- tulehdus silmän värikalvossa tai muissa silmän osissa (iriitti, uveiitti, iridosykliitti, etukammion punoitus)
- poikkeava tunne silmässä
- silmäluomen ärsytys
- silmämunan etupinnan turvotus (sarveiskalvon turvotus).
Harvinaiset haittavaikutukset (voi ilmetä enintään yhdellä potilaalla 1000:sta)
- sokeutuminen
- vamman aiheuttama linssin samentuminen (traumaperäinen kaihi)
- silmän hyytelömäisen osan tulehdus
- märkää silmässä.
Verisuonikasvutekijän estäjien, kuten Eylea-valmisteen vaikuttavan aineen, systemaattiseen käyttöön voi liittyä verisuonia tukkivien verihyytymien (valtimotukos) riski. Tällaiset tapahtumat voivat aiheuttaa sydäninfarktin tai aivohalvauksen. On olemassa teoreettinen riski, että Eylea-valmisteen injektointi silmään aiheuttaa tällaisen tapahtuman.
Kuten kaikki terapeuttiset proteiinit, myös Eylea-valmiste saattaa aiheuttaa immuunireaktion (vasta-aineiden muodostuminen).
Jos sinulla on kysyttävää haittavaikutuksista, käänny vauvan lääkärin puoleen
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla).
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
5. Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä pakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä jääkaapissa (2°C - 8°C). Ei saa jäätyä.
- Avaamaton läpipainopakkaus voidaan säilyttää poissa jääkaapista alle 25 °C:ssa enintään 24 tunnin ajan.
- Säilytä alkuperäispakkauksessa. Herkkä valolle.
- Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Eylea sisältää
- Vaikuttava aine on aflibersepti. Yhden esitäytetyn ruiskun sisältämä kokonaismäärä on vähintään 0,09 ml, mikä vastaa vähintään 3,6 mg:aa afliberseptiä. Yhdestä esitäytetystä ruiskusta saadaan 2 mg:n afliberseptiannos 0,05 millilitrassa.
- Muut aineet ovat: polysorbaatti 20 (E 432), natriumdivetyfosfaattimonohydraatti (pH:n säätöön), dinatriumvetyfosfaattiheptahydraatti (pH:n säätöön), natriumkloridi, sakkaroosi, injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Eylea on injektioneste, liuos, (injektio) esitäytetyssä ruiskussa. Liuos on väritön tai vaaleankeltainen. Pakkauskoko on 1 esitäytetty ruisku.
Myyntiluvan haltija
Bayer AG
51368 Leverkusen
Saksa
Valmistaja
Bayer AG
Müllerstraße 178
13353 Berlin
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi
Bayer Oy
Puh: +358-(0)20-78521
Tämä pakkausseloste on tarkistettu viimeksi 03/2024
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta http://www.ema.europa.eu/ .
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Eylea-valmisteen valmistelu ja anto aikuisille
Esitäytetty ruisku tulisi käyttää vain yhden silmän hoitamiseen.
Steriiliä esitäytetyn ruiskun läpipainopakkausta ei saa avata puhtaan toimenpidehuoneen ulkopuolella.
Esitäytetty ruisku sisältää enemmän kuin suositellun 2 mg:n afliberseptiannoksen (vastaa 0,05 ml:aa injektionestettä). Ylimäärä on poistettava ennen antoa.
Ennen lääkkeen antamista, liuos on tarkastettava silmämääräisesti mahdollisten hiukkasten ja/tai värimuutosten ja/tai minkä tahansa valmisteen fysikaalisen ulkonäön muutoksen havaitsemiseksi. Mikäli tällaista havaitaan, tulee lääkevalmiste hävittää.
Avaamaton läpipainopakkaus voidaan säilyttää poissa jääkaapista alle 25 °C:ssa enintään 24 tunnin ajan. Läpipainopakkauksen avaamisen jälkeen on jatkettava aseptisissa olosuhteissa.
Lasiaiseen annettavaan injektioon on käytettävä 30 G x ½ tuuman kokoista injektioneulaa.
Esitäytetyn ruiskun käyttöohjeet:
|
1.
|
Kun olet valmis antamaan Eylea-annoksen, avaa pahvipakkaus ja ota steriili läpipainopakkaus. Avaa läpipainopakkaus varovasti auki niin, että sen steriiliys säilyy. Pidä ruisku steriilillä tarjottimella, kunnes olet valmis valmistelemaan sen.
|
|
2.
|
Poista ruisku steriilistä läpipainopakkauksesta aseptista tekniikkaa käyttämällä.
|
|
3.
|
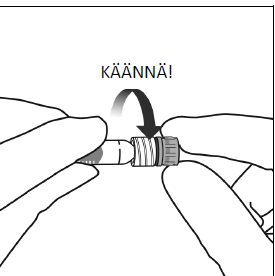
Poista ruiskun korkki pitämällä ruiskua toisessa kädessä samalla, kun tartut toisen käden peukalolla ja etusormella ruiskun korkkiin. Huomaa: ruiskukorkki pitää poistaa kiertämällä (älä katkaise sitä taittamalla).
|
|
|
4.
|
Jotta valmisteen steriiliys ei vaarannu, älä vedä mäntää taakse.
|
|
5.
|
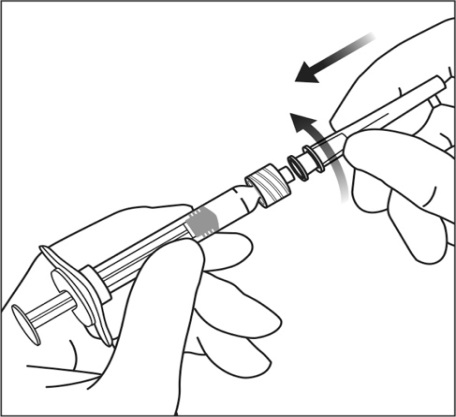
Väännä injektioneula tiukasti Luer-lukkoruiskun kärkeen aseptista tekniikkaa käyttämällä.
|
|
|
6.
|
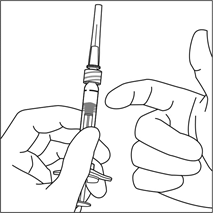
Pidä ruiskua neula ylöspäin ja tarkista, näkyykö ruiskussa kuplia. Jos ruiskussa on kuplia, naputa ruiskua varovasti sormella, kunnes kuplat nousevat pinnalle.
|
|
|
7.
|
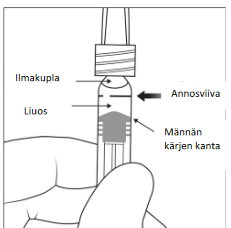
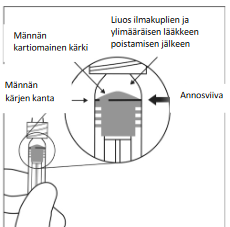
Poista kaikki kuplat ja ylimääräinen lääkevalmiste painamalla mäntää hitaasti niin, että männän kartiomaisen kärjen kanta (ei männän kärki) kohdistuu ruiskussa olevaan annosviivaan (vastaa 0,05 ml eli 2 mg afliberseptiä).
Huomaa: Männän täsmällinen kohdistaminen on erittäin tärkeää, koska männän väärästä kohdistamisesta voi seurata suositeltua annosta suurempi tai pienempi annostus
|
| |
|
|
|
8.
|
Injisoi painaen mäntää varovasti ja tasaisella paineella. Älä käytä ylimääräistä voimaa, kun mäntä on painettu ruiskun pohjaan. Älä anna ruiskussa havaittua jäännösliuosta.
|
| 9. |
Esitäytetty ruisku on tarkoitettu vain kertakäyttöön. Useiden annosten ottaminen esitäytetystä ruiskusta voi lisätä kontaminaation riskiä ja sen seurauksena infektion riskiä. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti |
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Eylea-valmisteen valmistelu ja anto keskosille
Esitäytetty ruisku tulisi käyttää vain yhden silmän hoitamiseen. Useiden annosten ottaminen esitäytetystä ruiskusta voi lisätä kontaminaation riskiä ja sen seurauksena infektion riskiä.
Steriiliä esitäytetyn ruiskun läpipainopakkausta ei saa avata puhtaan toimenpidehuoneen ulkopuolella. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Esitäytetty ruisku sisältää enemmän kuin suositellun 0,4 mg:n afliberseptiannoksen (vastaa 0,01 ml:aa injektionestettä). Keskosia hoidettaessa yhden 0,4 mg afliberseptiä sisältävän annoksen (vastaa 0,01 ml:aa injektionestettä) antamiseen on käytettävä pediatrista PICLEO-annostelulaitetta yhdessä esitäytetyn ruiskun kanssa. Ks. seuraava kohta ”Esitäytetyn ruiskun käyttöohjeet”.
Ennen lääkkeen antamista, liuos on tarkastettava silmämääräisesti mahdollisten hiukkasten ja/tai värimuutosten ja/tai minkä tahansa valmisteen fysikaalisen ulkonäön muutoksen havaitsemiseksi. Mikäli tällaista havaitaan, tulee lääkevalmiste hävittää.
Avaamaton läpipainopakkaus voidaan säilyttää poissa jääkaapista alle 25 °C:ssa enintään 24 tunnin ajan. Läpipainopakkauksen avaamisen jälkeen on jatkettava aseptisissa olosuhteissa.
Lasiaiseen annettavaan injektioon on käytettävä 30 G x ½ tuuman kokoista injektioneulaa.
Esitäytetyn ruiskun käyttöohjeet:
Valmistele esitäytetty ruisku käytettäväksi keskosille noudattamalla alla kuvattuja vaiheita 1 ja 2, ja noudata sitten pediatrisen PICLEO-annostelulaitteen pakkauksessa toimitettuja käyttöohjeita.
|
1.
|
Kun olet valmis antamaan Eylea-annoksen, avaa pahvipakkaus ja ota steriili läpipainopakkaus. Avaa läpipainopakkaus varovasti auki niin, että sen steriiliys säilyy. Pidä ruisku steriilillä tarjottimella, kunnes olet valmis valmistelemaan sen.
|
|
2.
|
Poista ruisku steriilistä läpipainopakkauksesta aseptista tekniikkaa käyttämällä.
|