IDELVION 250 IE pulver och vätska till injektionsvätska, lösning
IDELVION 500 IE pulver och vätska till injektionsvätska, lösning
IDELVION 1000 IE pulver och vätska till injektionsvätska, lösning
IDELVION 2000 IE pulver och vätska till injektionsvätska, lösning
IDELVION 3500 IE pulver och vätska till injektionsvätska, lösning
albutrepenonakog alfa (rekombinant koagulationsfaktor IX)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad IDELVION är och vad det används för
2. Vad du behöver veta innan du använder IDELVION
3. Hur du använder IDELVION
4. Eventuella biverkningar
5. Hur IDELVION ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad produkten är och vad den används för
Vad är IDELVION?
IDELVION är ett läkemedel för hemofili som ersätter naturlig koagulationsfaktor (levringsfaktor) IX. Den aktiva substansen i IDELVION är albutrepenonakog alfa (rekombinant fusionsprotein som länkar koaguleringsfaktor IX till albumin (rIX-FP)).
Faktor IX är inblandat i blodets levring. Patienter med hemofili B har en brist på denna faktor vilket innebär att deras blod inte kan levra sig lika snabbt som det ska och därför finns det en ökad benägenhet att blöda. IDELVION fungerar genom att ersätta faktor IX hos patienter med hemofili B för att deras blod ska kunna levra sig.
Vad används IDELVION för?
IDELVION används för att förebygga eller stoppa blödning som orsakats av brist på fungerande faktor IX hos patienter i alla åldrar med hemofili B (även kallat medfödd faktor IX-brist eller Christmas sjukdom).
2. Vad du behöver veta innan produkten används
Använd inte IDELVION:
- om du är allergisk mot den aktiva substansen (albutrepenonakog alfa) eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du är allergisk mot hamsterprotein.
Varningar och försiktighet
Det rekommenderas starkt att varje gång du använder IDELVION anteckna produktens namn och tillverkningssatsnummer, för att ha kontroll över vilka produkter och tillverkningssatser du har använt.
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder IDELVION.
- Allergiska överkänslighetsreaktioner kan uppkomma. Produkten innehåller spår av hamsterproteiner (se även ”Använd inte IDELVION”). Om symtom på allergisk reaktion uppstår ska du omedelbart sluta använda läkemedlet och kontakta din läkare eller behandlingscentret där du följs. Din läkare ska informera dig om tidiga tecken på överkänslighetsreaktioner. Dessa inkluderar nässelfeber, generaliserat hudutslag, tryck över bröstet, väsande andning, lågt blodtryck (hypotension) och anafylaxi (en allvarlig allergisk reaktion som orsakar svåra andningssvårigheter eller yrsel).
- På grund av risken för allergiska reaktioner med faktor IX ska din första dos med IDELVION ges under medicinsk övervakning där lämplig medicinsk vård för allergiska reaktioner kan ges.
- Att inhibitorer (antikroppar) bildas, är en känd komplikation som har rapporterats under behandling med IDELVION. Inhibitorerna gör att behandlingen slutar fungera ordentligt. Tala genast om för din läkare om din blödning inte kan kontrolleras med IDELVION. Du ska övervakas regelbundet vad gäller bildandet av inhibitorer.
- Om du har en lever- eller hjärtsjukdom eller om du nyligen har genomgått en stor operation, informera din läkare då det finns en ökad risk för blodpropp (koagulering).
- Om du behöver använda en central venkateter (CVK för injektion av IDELVION) så ska risken för komplikationer övervägas av din läkare, inklusive lokala infektioner, bakterier i blodet (bakteriemi) samt bildandet av blodproppar i blodkärl (trombos) där katetern sitter.
Andra läkemedel och IDELVION
- Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Graviditet och amning
- Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
- Under graviditet och amning ska IDELVION endast ges om det absolut behövs.
Körförmåga och användning av maskiner
IDELVION påverkar inte förmågan att framföra fordon eller använda maskiner.
IDELVION innehåller natrium
Detta läkemedel innehåller upp till 8,6 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 0,4 % av högsta rekommenderat dagligt intag av natrium för vuxna.
3. Hur produkten används
Din behandling ska påbörjas och ske under överinseende av en läkare som har erfarenhet av behandling av blödningsrubbningar.
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Din läkare kommer att beräkna den dos du behöver av IDELVION. Den mängd av IDELVION som du behöver och behandlingstiden beror på:
- svårighetsgraden på din sjukdom
- var blödningen är och hur omfattande den är
- ditt kliniska tillstånd och behandlingssvar
- din kroppsvikt.
IDELVION administreras av din läkare eller sjuksköterska som en injektion i en ven genom intravenös, (i.v.) injektion efter beredning av pulvret med det medföljande lösningsmedlet. Du eller någon annan kan också administrera IDELVION som en i.v.-injektion, men bara efter att ha fått lämplig träning.
Om du har använt för stor mängd av IDELVION
Kontakta din läkare omedelbart om du injicerar mer IDELVION än din läkare rekommenderat.
Om du slutar att använda IDELVION
Sluta inte att använda IDELVION utan att rådfråga läkare.
Beredning och administrering
Allmänna instruktioner
- Pulvret måste blandas med spädningsvätskan och dras upp från injektionsflaskan samtidigt som läkemedlet hålls sterilt (bakteriefritt). Din läkare kommer att visa dig hur du bereder lösningen och hur du drar upp lösningen korrekt från injektionsflaskan.
- IDELVION får inte blandas med andra läkemedel eller lösningar förutom de som nämns i avsnitt Förpackningens innehåll och övriga upplysningar.
- Lösningen ska vara klar och lätt opalescent (halvgenomskinlig), gul till färglös, d.v.s. den kan glimma till om den hålls upp mot ljuset men får inte innehålla några synliga partiklar. Efter filtrering eller fyllning av sprutan (se nedan) ska lösningen kontrolleras visuellt innan den används. Använd inte lösningen om den är oklar eller innehåller flagor eller partiklar.
- Oanvänd produkt eller avfall ska kasseras i enlighet med lokala riktlinjer och som instruerat av din läkare.
Beredning
Innan injektionsflaskorna öppnas, ska IDELVION pulver och vätska värmas till rums‑ eller kroppstemperatur. Detta kan göras antingen genom att flaskorna får stå i rumstemperatur i cirka en timme eller genom att hålla dem i händerna i några minuter.
UTSÄTT INTE injektionsflaskorna för direkt värme. Injektionsflaskorna får inte värmas över kroppstemperatur (37 ºC).
Avlägsna försiktigt plastlocken från flaskorna och rengör gummipropparnas ytor med en alkoholtork. Låt injektionsflaskorna torka innan Mix2Vial-förpackningen (som innehåller överföringssetet med filter) öppnas. Följ därefter nedanstående anvisningar.
Uppdragning och administrering
 8 8 | 8. Medan sprutkolven hålls intryckt, vänd flaskan upp och ned tillsammans med set och spruta. Dra in lösningen i sprutan genom att långsamt föra kolven tillbaka. |
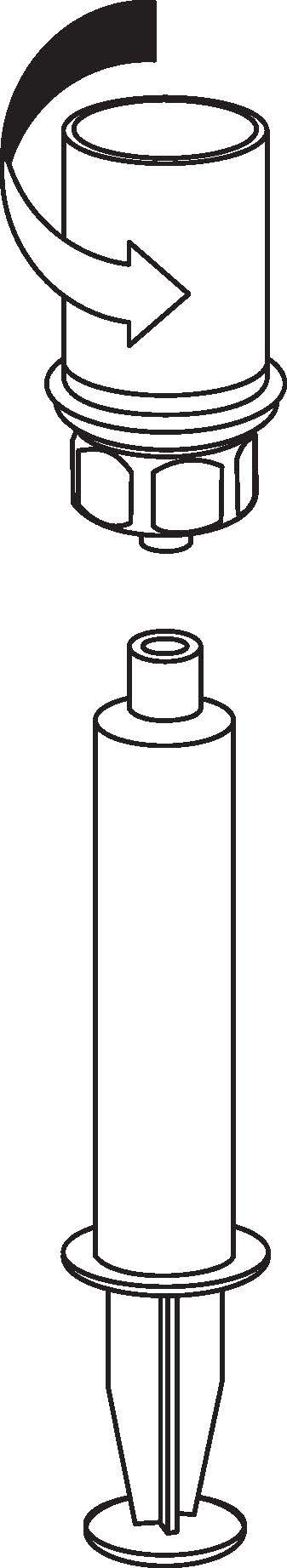 9 9 | 9. När all lösning har förts över till sprutan, fatta ett fast tag om sprutan (håll sprutan med kolven nedåt) och koppla bort den transparenta Mix2Vial‑adaptern från sprutan genom att skruva isär den moturs. |
Använd det medföljande venpunktionssetet och för in nålen i en ven. Låt blodet rinna bakåt till slutet av slangen. Fäst sprutan på den gängade låsanordningen i änden på venpunktionssetet. Injicera långsamt den färdigberedda lösningen in i venen (så som är bekvämt för dig, upp till max 5 ml/min), i enlighet med de instruktioner som du har fått från din läkare. Var noggrann med att inte få in något blod i sprutan med färdigberedd lösning.
Känn efter om du får några omedelbara biverkningar. Om du får några biverkningar som kan bero på administreringen av IDELVION, ska injektionen avbrytas (se även avsnitt Vad du behöver veta innan produkten används och Eventuella biverkningar).
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Kontakta genast din läkare:
- om du får symtom på allergisk reaktion (se nedan)
- om du märker att läkemedlet inte fungerar ordentligt
Följande biverkningar har observerats med faktor IX-läkemedel:
- Överkänslighetsreaktioner av allergityp är möjliga (vanliga) och kan innefatta följande symtom: nässelfeber, hudutslag (generaliserad urtikaria), tryck över bröstet, väsande andning, lågt blodtryck och anafylaxi (en kraftig allergisk reaktion som orsakar andningssvårigheter och yrsel). Sluta använda läkemedlet och kontakta omedelbart läkare om du får några sådana symtom.
- Inhibitorer: läkemedlet slutar att fungera som det ska (fortsatt blödning). Du kan utveckla en inhibitor (neutraliserande antikropp) till faktor IX (förekommer hos okänt antal användare), vilket innebär att faktor IX inte fungerar ordentligt längre. Om detta händer ska du omedelbart sluta använda läkemedlet och kontakta din läkare.
Följande biverkningar har observerats som vanliga med IDELVION (kan förekomma hos upp till 1 av 10 personer):
- Huvudvärk
- Reaktioner på injektionsstället
- Yrsel
- Hudutslag
Följande biverkningar har observerats som mindre vanliga (kan förekomma hos upp till 1 av 100 personer):
Biverkningar hos barn och ungdomar
Biverkningar hos barn förväntas vara desamma som hos vuxna.
Rapportering av biverkningar
Om du får biverkningar, tala med apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
5. Hur produkten ska förvaras
- Förvara detta läkemedel utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på etiketten och kartongen.
- Förvaras vid högst 25 °C.
- Får ej frysas.
- Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
- Den färdigberedda produkten ska företrädesvis användas omedelbart.
- Om den färdigberedda produkten inte administreras omedelbart är förvaringstid och förhållanden före användning användarens ansvar.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är:
250 IE per injektionsflaska: efter beredning med 2,5 ml vatten för injektionsvätskor innehåller lösningen 100 IE/ml albutrepenonakog alfa.
500 IE per injektionsflaska: efter beredning med 2,5 ml vatten för injektionsvätskor innehåller lösningen 200 IE/ml albutrepenonakog alfa.
1000 IE per injektionsflaska: efter beredning med 2,5 ml vatten för injektionsvätskor innehåller lösningen 400 IE/ml albutrepenonakog alfa.
2000 IE per injektionsflaska: efter beredning med 5 ml vatten för injektionsvätskor innehåller lösningen 400 IE/ml albutrepenonakog alfa.
3500 IE per injektionsflaska: efter beredning med 5 ml vatten för injektionsvätskor innehåller lösningen 700 IE/ml albutrepenonakog alfa.
Övriga innehållsämnen är:
Natriumcitrat, polysorbat 80, mannitol, sackaros och saltsyra (för pH-justering)
Se sista stycket i avsnitt Vad du behöver veta innan produkten används.
Spädningsvätska: Vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
IDELVION är ett ljusgult till vitt pulver och tillhandahålls med vatten för injektionsvätskor som spädningsvätska.
Den färdigberedda lösningen ska vara klar eller lätt opalescent, gul till färglös d.v.s. den kan glimma till om den hålls mot ljuset, men den får inte innehålla några synliga partiklar.
Förpackningsutföranden:
En förpackning med 250, 500 eller 1000 IE innehåller:
1 injektionsflaska med pulver
1 injektionsflaska med 2,5 ml vatten för injektionsvätskor
1 överföringsset med filter 20/20
Innerkartongen innehåller:
1 5 ml engångsspruta
1 venpunktionsset
2 alkoholtorkar
1 icke-sterilt plåster
En förpackning med 2000 IE eller 3500 IE innehåller:
1 injektionsflaska med pulver
1 injektionsflaska med 5 ml vatten för injektionsvätskor
1 överföringsset med filter 20/20
Innerkartongen innehåller:
1 10 ml engångsspruta
1 venpunktionsset
2 alkoholtorkar
1 icke-sterilt plåster
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
CSL Behring GmbH
Emil-von-Behring-Straße 76
35041 Marburg
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Finland
CSL Behring AB
Tel: +46 8 544 966 70
Denna bipacksedel ändrades senast 02/2023
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu .
Direktiv för experterna inom hälsovården
Dosering
Substitutionsbehandlingens dos och varaktighet beror på svårighetsgraden på faktor IX-bristen, blödningens lokalisation och omfattning samt på patientens kliniska tillstånd.
Antalet faktor IX‑enheter som administreras anges i Internationella Enheter (IE), vilket är relaterat till aktuell WHO‑standard för faktor IX‑produkter. Faktor IX‑aktiviteten i plasma anges antingen i procent (i förhållande till normal human plasma) eller i Internationella Enheter (i förhållande till en internationell standard för faktor IX i plasma).
En Internationell Enhet (IE) faktor IX-aktivitet är likvärdigt med den mängd faktor IX som finns i en ml normal human plasma.
Behandling vid behov
Beräkningen av lämplig dos av faktor IX baseras på det empiriska fyndet att 1 IE faktor IX per kg kroppsvikt ökar faktor IX aktiviteten i plasma med i genomsnitt 1,3 IE/dl (1,3 % av normalaktivitet) hos patienter ≥ 12 år och med 1,0 IE/dl (1,0 % av normalaktivitet) hos patienter < 12 år. Den lämpliga dosen bestäms med hjälp av följande formel:
Lämplig dos (IE) = kroppsvikt (kg) x önskad ökning av faktor IX (% av normalvärdet eller IE/dl) x {reciproka värdet av uppmätt in vivo recovery (IE/kg per IE/dl)}
Förväntad ökning av faktor IX (IE/dl eller % av normalvärdet) = dos (IE) x in vivo recovery (IE/dl per IE/kg)/kroppsvikt (kg)
Dosen som administreras och doseringsintervallet ska alltid anpassas till den kliniska effekten i varje enskilt fall.
Patienter < 12 års ålder
Med en inkrementell in vivo recovery av 1 IE/dl per 1 IE/kg ska dosen beräknas enligt följande:
Lämplig dos (IE) = kroppsvikt (kg) x önskad ökning av faktor IX (IE/dl) x 1 dl/kg.
Exempel
- En maximal nivå på 50 % av normalvärdet krävs hos en patient med svår hemofili B och som väger 20 kg. Den lämpliga dosen skulle i sådana fall vara 20 kg x 50 IE/dl x 1 dl/kg = 1000 IE.
- En dos på 1000 IE av IDELVION som administreras till en patient som väger 25 kg förväntas efter injektion resultera i en maximal faktor IX-ökning på 1000 IE/25 kg x 1,0 (IE/dl per IE/kg) = 40 IE/dl (40 % av normalvärdet).
Patienter ≥ 12 års ålder
Med en inkrementell in vivo recovery av 1,3 IE/dl per 1 IE/kg ska dosen beräknas enligt följande:
Lämplig dos (IE) = kroppsvikt (kg) x önskad ökning av faktor IX (IE/dl) x 0,77 dl/kg
Exempel
- En maximal nivå på 50 % av normalvärdet krävs hos en patient med svår hemofili B och som väger 80 kg. Den lämpliga dosen skulle i sådana fall vara 80 kg x 50 IE/dl x 0,77 dl/kg = 3 080 IE.
- En dos på 2000 IE av IDELVION som administreras till en patient som väger 80 kg förväntas efter injektion resultera i en maximal faktor IX-ökning på 2000 IE x 1,3 (IE/dl per IE/kg) /80 kg = 32,5 IE/dl (32,5 % av normalvärdet).
Vid följande hemorragiska tillstånd ska faktor IX‑aktiviteten inte sjunka under den angivna aktivitetsnivån i plasma (i % av det normala eller IE/dl) inom tidsperioden ifråga. Följande tabell kan användas som vägledning för dosering vid blödningsepisoder och kirurgi:
|
Grad av hemorragi/typ av kirurgiskt ingrepp
|
Lämplig faktor IX‑nivå (%) (IE/dl)
|
Doseringsintervall (timmar)/behandlingsperiod (dagar)
|
|
Hemorragi
Mindre eller medelsvår hemartros, muskelblödning (förutom iliopsoas) eller oral blödning
|
30‑60
|
Enkeldos bör vara tillräckligt för de flesta blödningar. Underhållsdos efter 24‑72 timmar om det finns ytterligare tecken på blödning.
|
|
Mer omfattande hemorragi
Livshotande blödningar, djupa muskelblödningar inklusive iliopsoas
|
60‑100
|
Upprepa var 24‑72 timme den första veckan, och ge sedan underhållsdoser varje vecka tills blödning upphör och läkning uppnåtts.
|
|
Mindre kirurgiska ingrepp
Inklusive okomplicerad utdragning av en tand
|
50‑80 (pre- och postoperativt)
|
Enkeldos kan vara tillräckligt för majoriteten av mindre kirurgiska ingrepp. Om det behövs kan underhållsdoser ges efter 24‑72 timmar tills blödning upphör och läkning uppnåtts.
|
|
Större kirurgiska ingrepp
|
60‑100
(pre- och postoperativt)
|
Upprepa var 24‑72 timme den första veckan, och ge sedan underhållsdoser 1‑2 gånger i veckan tills blödning upphör och läkning uppnåtts.
|
Profylax
Vid långtidsprofylax för att förebygga blödning hos patienter med svår hemofili B är den rekommenderade dosen 35 till 50 IE/kg en gång per vecka.
Vissa patienter som är välkontrollerade vid behandling en gång per vecka kan behandlas med upp till 75 IE/kg med intervall på 10 eller 14 dagar. För patienter > 18 år kan ytterligare förlängning av behandlingsintervallet övervägas.
I vissa fall, särskilt hos yngre patienter, kan kortare dosintervall eller högre doser vara nödvändiga.
Efter en blödningsepisod under profylaxbehandling ska patienter fortsätta med sin profylaxregim så noggrant som möjligt. IDELVION ska administreras med minst 24 timmar mellan 2 doseringar, eller längre om det bedöms passande för patienten.
Pediatrisk population
För långtidsprofylax är den rekommenderade dosen 35 till 50 IE/kg en gång per vecka (se avsnitt. För ungdomar 12 år och äldre är dosrekommendationerna desamma som för vuxna (se ovan).
Varningar och försiktighet
Inhibitorer
Efter upprepad behandling med humana koagulationsfaktor IX-produkter ska patienter monitoreras för utvecklingen av neutraliserande antikroppar (inhibitorer) som ska kvantifieras i Bethesda enheter (BU) genom användning av lämplig biologisk testning.
Fall som visar på en korrelation mellan förekomsten av faktor IX-inhibitorer och allergiska reaktioner har visats i litteraturen. Därför ska patienter som får allergiska reaktioner utredas för förekomst av inhibitorer. Det bör noteras att patienter med faktor IX-inhibitorer kan ha en förhöjd risk för anafylaxi vid administrering av faktor IX.
Övervakning under behandling
Under behandlingen rekommenderas bestämning av faktor IX-nivåerna som vägledning för att anpassa dos och doseringsintervall vid upprepade infusioner. Enskilda patienter kan variera i sina svar på faktor IX, uppvisa olika halveringstider och olika nivåer av in vivo recovery. Dos baserad på kroppsvikt kan behöva justeras hos underviktiga eller överviktiga patienter. I synnerhet när det gäller större kirurgiska ingrepp är en noggrann övervakning av substitutionsbehandlingen genom koagulationsanalys (faktor IX-aktivitet i plasma) nödvändig.
Vid användning av ett in vitro tromboplastintids (aPTT)-baserat en-stegs koagulationstest för bestämning av faktor IX-aktiviteten i patientens blodprov kan faktor IX-aktiviteten i plasma påverkas signifikant både av vilken sorts aPTT-reagens och av vilken referensstandard som används i analysen. Mätningar med ett en-stegs koagulationstest med ett kaolin-baserad aPTT-reagens eller ett ”Actin FS” aPTT-reagens kommer sannolikt resultera i en underskattning av aktivitetsnivåerna. Detta är särskilt viktigt när man byter laboratorium och/eller reagens som används i analysen.