BESPONSA 1 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
inotutsumabi-otsogamisiini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä uudelleen.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä BESPONSA on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin saat BESPONSA-valmistetta
- Miten BESPONSA-valmistetta annetaan
- Mahdolliset haittavaikutukset
- BESPONSA-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
BESPONSA-valmisteen vaikuttava aine on inotutsumabi-otsogamisiini. Se kuuluu lääkeaineryhmään, jonka vaikutus kohdistuu syöpäsoluihin. Näitä lääkkeitä kutsutaan kasvaimen kasvua estäviksi lääkeaineiksi.
BESPONSA-valmistetta käytetään aikuisten akuutin lymfaattisen leukemian hoitoon. Akuutti lymfaattinen leukemia on verisyöpä, joka ilmenee valkosolujen liiallisena määränä veressä. BESPONSA on tarkoitettu akuutin lymfaattisen leukemian hoitoon aikuispotilaille, joille on aiemmin kokeiltu muita hoitoja, mutta ne eivät ole tehonneet.
BESPONSA vaikuttaa kiinnittymällä soluihin, joissa on CD22:ksi kutsuttua proteiinia. Lymfoblastileukemiasoluissa on tätä proteiinia. Lääke kiinnittyy lymfoblastileukemiasoluihin ja vapauttaa soluihin ainetta, joka häiritsee solujen DNA:ta ja lopulta tuhoaa ne.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä BESPONSA-valmistetta
- jos olet allerginen inotutsumabi-otsogamisiinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on aikaisemmin todettu vaikea veno-okklusiivinen tauti (sairaus, jossa maksan verisuonet vaurioituvat ja verihyytymät tukkivat ne) tai sinulla on parhaillaan tämä sairaus.
- jos sinulla on vaikea maksasairaus, esim. kirroosi (sairaus, jossa maksa ei toimi kunnolla pitkän ajan kuluessa syntyneen vaurion vuoksi), nodulaarinen regeneratiivinen hyperplasia (sairaus, johon liittyy merkkejä ja oireita kohonneesta porttilaskimopaineesta; voi olla seurausta pitkäaikaisesta lääkkeiden käytöstä) tai aktiivinen hepatiitti (sairaus, joka ilmenee maksatulehduksena).
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin sinulle annetaan BESPONSA-valmistetta,
- jos sinulla on aiemmin ollut maksavaivoja tai maksasairauksia, tai jos sinulla on merkkejä ja oireita vakavasta sairaudesta nimeltään maksan veno-okklusiivinen tauti, jossa maksan verisuonet vaurioituvat ja verihyytymät tukkivat ne. Veno-okklusiivinen tauti voi olla kuolemaan johtava ja siihen liittyy nopeaa painonnousua, kipua ylävatsan oikealla puolella, maksan koon suurenemista, vatsan turvotusta aiheuttavaa nesteen kertymistä elimistöön ja verikoetuloksissa bilirubiini‑ ja/tai maksaentsyymiarvojen suurenemista (saattaa aiheuttaa ihon tai silmien keltaisuutta). Tämä sairaus voi ilmetä BESPONSA-hoidon aikana tai sitä seuraavan kantasolusiirron jälkeen. Kantasolusiirrossa toisen ihmisen kantasoluja (soluja, joista kehittyy uusia verisoluja) siirretään verenkiertoosi. Voit saada tämän hoidon, jos saat täydellisen vasteen BESPONSA-hoitoon.
- jos sinulla on merkkejä tai oireita verisolujen, kuten neutrofiilien, punasolujen, valkosolujen, lymfosyyttien tai verihiutaleiden, liian pienestä määrästä; neutrofiilien vähyyteen liittyy joskus kuumetta. Tällaisia merkkejä ja oireita ovat infektion ilmaantuminen, kuume, mustelmaherkkyys tai usein toistuvat nenäverenvuodot.
- jos sinulla on tiputukseen (infuusioon) liittyvän reaktion merkkejä ja oireita, kuten kuumetta ja vilunväristyksiä tai hengitysvaikeuksia BESPONSA-infuusion aikana tai pian sen jälkeen.
- jos sinulla on tuumorilyysioireyhtymän merkkejä ja oireita. Näitä voivat olla oireet mahassa ja suolistossa (esim. pahoinvointi, oksentelu, ripuli), sydämessä (esim. rytmihäiriöt), munuaisissa (esim. virtsamäärän väheneminen, verta virtsassa) sekä hermostossa ja lihaksissa (esim. lihasnykäykset, -heikkous ja -krampit). Oireet ilmenevät BESPONSA-infuusion aikana tai pian sen jälkeen.
- jos sinulla on ilmennyt QT-ajan pitenemistä (muutos sydämen sähköisessä aktiivisuudessa, josta voi olla seurauksena sydänrytmin vakava häiriintyminen) tai taipumusta tähän, jos käytät QT-aikaa tunnetusti pidentäviä lääkkeitä, ja/tai jos elektrolyyttiarvosi (esim. kalsium, magnesium ja kalium) ovat poikkeavat.
- jos amylaasi- tai lipaasientsyymiarvosi ovat suurentuneet, mikä voi olla merkkinä haima-, maksa-, sappirakko- tai sappitieongelmista.
Kerro heti lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos tulet raskaaksi BESPONSA-hoidon aikana tai 8 kuukauden kuluessa hoidon päättymisestä.
Lääkäri määrää sinut säännöllisesti verikokeisiin BESPONSA-hoidon aikana verenkuvan seuraamiseksi. Ks. myös kohta Mahdolliset haittavaikutukset.
Hoidon ja erityisesti aloitusta seuraavan parin ensimmäisen päivän aikana valkosolumääräsi voi pienentyä vaikea-asteisesti (neutropenia) ja tähän voi myös liittyä kuumetta (kuumeinen neutropenia).
Hoidon ja erityisesti aloitusta seuraavan parin ensimmäisen päivän aikana maksaentsyymiarvosi voivat suurentua. Lääkäri määrää sinut säännöllisesti verikokeisiin BESPONSA-hoidon aikana maksaentsyymiarvojen seuraamiseksi.
BESPONSA-hoito voi pidentää QT-aikaa (muutos sydämen sähköisessä aktiivisuudessa, josta voi olla seurauksena sydänrytmin vakava häiriintyminen). Lääkäri määrää sinut EKG-tutkimukseen (sydänsähkökäyrän rekisteröintiin) ja verikokeisiin elektrolyyttien (esim. kalsium, magnesium, kalium) määrittämiseksi ennen ensimmäistä BESPONSA-annosta ja myös hoidon aikana. Ks. myös kohta Mahdolliset haittavaikutukset.
Lääkäri seuraa sinua tuumorilyysioireyhtymän merkkien ja oireiden varalta BESPONSA-valmisteen annon jälkeen. Ks. myös kohta Mahdolliset haittavaikutukset.
Lapset ja nuoret
BESPONSA-valmistetta ei saa käyttää lapsille eikä alle 18‑vuotiaille nuorille, koska tietoja käytöstä tälle potilasryhmälle on saatavilla rajoitetusti.
Muut lääkevalmisteet ja BESPONSA
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan otat, olet äskettäin ottanut tai saatat ottaa muita lääkkeitä. Kerro myös, jos käytät ilman lääkemääräystä saatavia lääkkeitä ja kasvirohdosvalmisteita.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai sairaanhoitajalta neuvoa ennen tämän lääkkeen käyttöä.
Raskaudenehkäisy
Sinun on vältettävä raskaaksi tulemista tai lapsen siittämistä. Naisten on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään 8 kuukautta viimeisen annoksen jälkeen. Miesten on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään 5 kuukautta viimeisen annoksen jälkeen.
Raskaus
BESPONSA-valmisteen vaikutuksia raskaana oleviin naisiin ei tunneta, mutta vaikutusmekanisminsa perusteella BESPONSA voi vahingoittaa syntymätöntä lasta. BESPONSA-valmistetta ei pidä käyttää raskauden aikana, paitsi jos lääkärin mielestä se on sopivin lääke.
Ota heti yhteyttä lääkäriin, jos sinä tulet tai kumppanisi tulee raskaaksi tämän lääkehoidon aikana.
Hedelmällisyys
Miesten ja naisten tulisi hakeutua hedelmällisyyden säilyttämistä koskevaan neuvontaan ennen hoitoa.
Imetys
Jos tarvitset BESPONSA-hoitoa, sinun on lopetettava imetys hoidon ajaksi ja vähintään 2 kuukauden ajaksi hoidon päättymisestä. Keskustele lääkärin kanssa.
Ajaminen ja koneiden käyttö
Jos olet epätavallisen väsynyt (hyvin yleinen BESPONSA-hoidon haittavaikutus), älä aja autoa äläkä käytä koneita.
BESPONSA sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 1 mg inotutsumabi-otsogamisiinia eli sen voidaan sanoa olevan ”natriumiton”.
3. Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta tai sairaanhoitaja on neuvonut. Tarkista ohjeet lääkäriltä, apteekkihenkilökunnalta tai sairaanhoitajalta, jos olet epävarma.
Miten BESPONSA annetaan
- Lääkäri päättää sinulle sopivan annoksen.
- Lääkäri tai sairaanhoitaja antaa BESPONSA-valmisteen sinulle 1 tunnin kestoisena tiputuksena (infuusiona) laskimoon.
- Saat yhden annoksen kerran viikossa. Jokaisessa hoitosyklissä on 3 annosta.
- Jos lääke tehoaa hyvin ja sinulle suunnitellaan kantasolusiirrettä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä), voit saada tätä valmistetta 2 hoitosykliä tai enintään 3 hoitosykliä.
- Jos lääke tehoaa hyvin, mutta sinulle ei suunnitella kantasolusiirrettä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä), voit saada tätä valmistetta enintään 6 hoitosykliä.
- Jos et saa hoitovastetta 3 syklin aikana, hoitosi lopetetaan.
- Jos sinulla ilmenee tiettyjä haittavaikutuksia, lääkäri saattaa muuttaa annostasi, keskeyttää BESPONSA-hoidon tilapäisesti tai lopettaa sen kokonaan.
- Lääkäri saattaa pienentää annosta hoitovasteesi mukaan.
- Lääkäri määrää sinulle hoidon aikana verikokeita haittavaikutusten varalta ja hoitovasteen seuraamiseksi.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Ennen BESPONSA-hoitoa annettavat lääkkeet
Saat ennen BESPONSA-hoitoa muita lääkkeitä (esilääkitystä), jotka auttavat vähentämään infuusioreaktioita ja muita mahdollisia haittavaikutuksia. Tällaisia lääkkeitä ovat kortikosteroidit (esim. deksametasoni), kuumelääkkeet (kuumetta alentavat lääkkeet) ja antihistamiinit (allergisia reaktioita vähentävät lääkkeet).
Saatat saada ennen BESPONSA-hoitoa lääkkeitä ja nesteytystä estämään tuumorilyysioireyhtymän ilmenemistä. Tuumorilyysioireyhtymään liittyy monenlaisia oireita mahassa ja suolistossa (esim. pahoinvointi, oksentelu, ripuli), sydämessä (esim. rytmihäiriöt), munuaisissa (esim. virtsamäärän väheneminen, verta virtsassa) sekä hermostossa ja lihaksissa (esim. lihasnykäykset, -heikkous ja -krampit).
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Jotkin seuraavista haittavaikutuksista voivat olla vakavia.
Kerro heti lääkärille, jos sinulla ilmenee jokin seuraavien vakavien haittavaikutusten merkki tai oire:
- infuusioon liittyvä reaktio (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä); merkkejä ja oireita ovat mm. kuume ja vilunväristykset tai hengitysvaikeudet BESPONSA-infuusion aikana tai pian sen jälkeen.
- veno-okklusiivinen tauti (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä); merkkejä ja oireita ovat mm. nopea painonnousu, kipu ylävatsan oikealla puolella, maksan koon suureneminen, vatsan turvotusta aiheuttava nesteen kertyminen elimistöön ja bilirubiini‑ ja/tai maksaentsyymiarvojen suureneminen (saattaa aiheuttaa ihon ja silmien keltaisuutta).
- verisolujen, kuten neutrofiilien, punasolujen, valkosolujen, lymfosyyttien tai verihiutaleiden, liian pieni määrä; neutrofiilien vähyyteen liittyy joskus kuumetta (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä); merkkejä ja oireita ovat mm. infektion ilmaantuminen, kuume, mustelmaherkkyys tai usein toistuvat nenäverenvuodot.
- tuumorilyysioireyhtymä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä); tähän voi liittyä erilaisia oireita mahassa ja suolistossa (esim. pahoinvointi, oksentelu, ripuli), sydämessä (esim. rytmihäiriöt), munuaisissa (esim. virtsamäärän väheneminen, verta virtsassa) sekä hermostossa ja lihaksissa (esim. lihasnykäykset, -heikkous ja -krampit).
- QT-ajan piteneminen (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä); merkkejä ja oireita on mm. muutos sydämen sähköisessä aktiivisuudessa, josta voi olla seurauksena sydänrytmin vakava häiriintyminen. Kerro lääkärille, jos sinulla ilmenee oireita, kuten heitehuimausta, pyörrytystä tai pyörtymistä.
Muita mahdollisia haittavaikutuksia voivat olla seuraavat:
Hyvin yleiset: voi esiintyä useammalla kuin 1 potilaalla kymmenestä
- infektiot
- valkosolujen määrän väheneminen, mikä saattaa aiheuttaa yleistä heikkoutta ja lisätä infektioherkkyyttä.
- lymfosyyttien (tietyntyyppisiä verisoluja) määrän väheneminen, mikä saattaa lisätä infektioherkkyyttä.
- punasolujen määrän väheneminen, mikä saattaa aiheuttaa väsymystä ja hengenahdistusta.
- ruokahalun heikkeneminen
- päänsärky
- verenvuoto
- vatsakipu
- oksentelu
- ripuli
- pahoinvointi
- suutulehdus
- ummetus
- suurentunut bilirubiiniarvo, mikä voi johtaa ihon, silmien ja muiden kudosten kellertävään väriin
- kuume
- vilunväristykset
- väsymys
- maksaentsyymipitoisuuksien suureneminen veressä (voi olla merkkinä maksavauriosta).
Yleiset: voi esiintyä enintään 1 potilaalla kymmenestä
- erityyppisten verisolujen määrän väheneminen
- liiallinen virtsahappopitoisuus veressä
- nesteen liiallinen kertyminen vatsaan
- vatsan turvotus
- sydänrytmin muutokset (voivat näkyä sydänsähkökäyrässä)
- poikkeavan suuri veren amylaasiarvo (entsyymi, jota tarvitaan ruoansulatuksessa ja tärkkelyksen muuntamisessa sokereiksi)
- poikkeavan suuri veren lipaasiarvo (entsyymi, jota tarvitaan ruoassa olevien rasvojen käsittelyyn)
- yliherkkyys.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä injektiopullon etiketissä ja kotelossa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Avaamaton injektiopullo
- Säilytä jääkaapissa (2–8 °C).
- Säilytä alkuperäisessä kotelossa. Herkkä valolle.
- Ei saa jäätyä.
Käyttökuntoon saatettu liuos
- Käytä heti tai säilytä jääkaapissa (2–8 °C) enintään 4 tuntia.
- Herkkä valolle.
- Ei saa jäätyä.
Laimennettu liuos
- Käytä heti tai säilytä huoneenlämmössä (20–25 °C) tai jääkaapissa (2–8 °C). Enimmäisaika valmisteen käyttökuntoon saattamisesta annon lopettamiseen on 8 tuntia, josta enintään 4 tuntia käyttökuntoon saattamisen ja laimentamisen välillä.
- Herkkä valolle.
- Ei saa jäätyä.
Tämä lääke on tarkastettava ennen antoa silmämääräisesti hiukkasten ja värjäytymien varalta. Älä käytä valmistetta, jos havaitset hiukkasia tai liuoksen värjäytymistä.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy lääkäriltä käyttämättömien lääkkeiden hävittämisestä. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä BESPONSA sisältää
- Vaikuttava aine on inotutsumabi-otsogamisiini. Yksi injektiopullo sisältää 1 mg inotutsumabi-otsogamisiinia. Käyttökuntoon saattamisen jälkeen 1 millilitra liuosta sisältää 0,25 mg inotutsumabi-otsogamisiinia.
- Muut aineet ovat sakkaroosi, polysorbaatti 80, natriumkloridi ja trometamiini (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Lääkevalmisteen kuvaus ja pakkauskoot
BESPONSA on kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos (kuiva-aine välikonsentraattia varten).
Yksi BESPONSA-pakkaus sisältää:
- 1 lasinen injektiopullo, joka sisältää valkoisen tai luonnonvalkoisen kylmäkuivatun kakun tai jauheen.
Myyntiluvan haltija
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Belgia
Valmistaja
Pfizer Service Company BV
Hoge Wei 10
B-1930, Zaventem
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 43 00 40
Tämä pakkausseloste on tarkistettu viimeksi 12/2023
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu . Siellä on myös linkkejä muille harvinaisia sairauksia ja niiden hoitoa käsitteleville verkkosivuille.
Tämä pakkausseloste on saatavissa kaikilla EU-kielillä Euroopan lääkeviraston verkkosivustolla.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille. Katso yksityiskohtaiset tiedot annostuksesta ja annosmuutoksista valmisteyhteenvedosta.
Antotapa
BESPONSA annetaan 1 tunnin kestävänä infuusiona laskimoon.
BESPONSA-valmistetta ei tule antaa laskimoon nopeana tai hyvin nopeana boluksena.
BESPONSA on saatettava käyttökuntoon ja laimennettava ennen antoa.
BESPONSA tulee antaa 3–4 viikon sykleissä.
Jos potilas siirtyy kantasolusiirtoon, hoidon suositeltu kesto on 2 sykliä. Kolmatta sykliä voidaan harkita, jos potilas ei saavuta CR:ää/CRi:tä ja MRD-negatiivisuutta 2 syklin jälkeen. Jos potilas ei siirry kantasolusiirtoon, hoitoa voidaan antaa enintään 6 sykliä. Jos potilas ei saavuta CR:ää/CRi:tä 3 syklin aikana, hoito tulisi lopettaa (ks. valmisteyhteenvedon kohta 4.2).
Jäljempänä olevassa taulukossa on esitetty suositellut annostusohjelmat.
Ensimmäisessä syklissä kaikille potilaille suositeltu kokonaisannos on 1,8 mg/m2/sykli jaettuna 3 annokseen päivinä 1 (0,8 mg/m2), 8 (0,5 mg/m2) ja 15 (0,5 mg/m2). Syklin 1 kesto on 3 viikkoa, mutta se voidaan pidentää 4 viikkoon, jos potilas saavuttaa CR:n tai CRi:n, ja/tai jos tarpeen toksisuudesta toipumiseen.
Seuraavissa sykleissä suositeltu kokonaisannos on 1,5 mg/m2/sykli jaettuna 3 annokseen päivinä 1 (0,5 mg/m2), 8 (0,5 mg/m2) ja 15 (0,5 mg/m2), jos potilas saavuttaa CR:n/CRi:n, tai 1,8 mg/m2/sykli jaettuna 3 annokseen päivinä 1 (0,8 mg/m2), 8 (0,5 mg/m2) ja 15 (0,5 mg/m2), jos potilas ei saavuta CR:ää/CRi:tä. Toisesta syklistä alkaen syklin kesto on 4 viikkoa.
Syklin 1 ja sitä seuraavien syklien annostusohjelma hoitovasteen mukaisesti
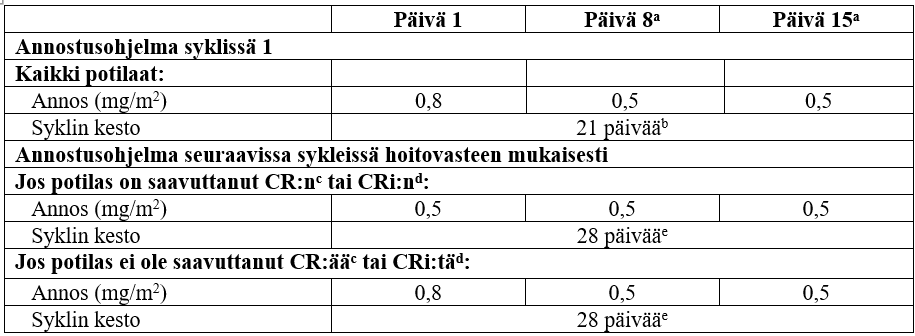
Lyhenteet: B-Neut = absoluuttinen neutrofiilimäärä, CR = täydellinen remissio, CRi = täydellinen remissio, osittainen hematologinen toipuminen.
a +/- 2 päivää (antoväli vähintään 6 päivää).
b Sykli voidaan pidentää enintään 28 päivään (eli 7 päivän hoitotauko alkaen päivästä 21), jos potilas saavuttaa CR:n/CRi:n, ja/tai jos tarpeen toksisuudesta toipumiseen.
c CR = blastisolujen osuus luuytimen soluista < 5 %, perifeerisessä veressä ei leukeemisia blasteja, perifeerisen veren verisolumäärien täydellinen palautuminen (verihiutaleet ≥ 100 × 109/l ja B-Neut ≥ 1 × 109/l) ja mahdollinen ekstramedullaarinen tauti hävinnyt.
d CRi = blastisolujen osuus luuytimen soluista < 5 %, perifeerisessä veressä ei leukeemisia blasteja, perifeerisen veren verisolumäärien osittainen palautuminen (verihiutaleet < 100 × 109/l ja/tai B-Neut < 1 × 109/l) ja mahdollinen ekstramedullaarinen tauti hävinnyt.
e 7 päivän hoitotauko alkaen päivästä 21.
Ohjeet käyttökuntoon saattamiseen, laimentamiseen ja antoon
Käytä asianmukaista aseptista tekniikkaa valmisteen käyttökuntoon saattamisessa ja laimentamisessa. Koska inotutsumabi-otsogamisiini (jonka tiheys on 1,02 g/ml 20 °C:n lämpötilassa) on valolle herkkä, se on suojattava ultraviolettisäteilyltä käyttökuntoon saattamisen, laimentamisen ja annon aikana.
Enimmäisaika valmisteen käyttökuntoon saattamisesta annon lopettamiseen on 8 tuntia, josta enintään 4 tuntia käyttökuntoon saattamisen ja laimentamisen välillä.
Käyttökuntoon saattaminen:
- Laske annos (mg) ja tarvittava BESPONSA-injektiopullojen lukumäärä.
- Jokaisen 1 mg:n injektiopullon sisältö liuotetaan 4 ml:lla injektionesteisiin käytettävää vettä, jolloin saadaan 0,25 mg/ml BESPONSA-liuosta kerta-antoon.
- Pyörittele injektiopulloa varovasti liukenemisen edistämiseksi. Älä ravista.
- Tarkasta saatu liuos hiukkasten ja värjäytymien varalta. Liuoksen on oltava kirkasta tai hieman sameaa ja väritöntä, eikä siinä saa näkyä hiukkasia. Älä käytä valmistetta, jos havaitset hiukkasia tai liuoksen värjäytymistä.
- BESPONSA ei sisällä bakteriostaattisia säilytysaineita. Käyttökuntoon saatettu liuos on käytettävä heti. Jos liuosta ei voida käyttää heti, sitä voidaan säilyttää jääkaapissa (2–8 °C) enintään 4 tuntia. Herkkä valolle. Ei saa jäätyä.
Laimentaminen:
- Laske, kuinka paljon käyttökuntoon saatettua liuosta tarvitaan, jotta saadaan potilaan kehon pinta-alaan perustuva asianmukainen annos. Vedä laskemasi liuosmäärä injektiopullo(i)sta ruiskuun. Herkkä valolle. Hävitä injektiopulloon mahdollisesti käyttämättä jäänyt liuos.
- Lisää käyttökuntoon saatettu liuos infuusiosäiliöön, jossa on 9 mg/ml (0,9 %) natriumkloridi-injektioliuosta niin, että nimelliseksi kokonaistilavuudeksi saadaan 50 ml. Lopullisen pitoisuuden tulisi olla 0,01–0,1 mg/ml. Herkkä valolle. Infuusiosäiliöksi suositellaan polyvinyylikloridista (PVC) (di(2-etyyliheksyyli)ftalaattia [DEHP:tä] sisältävä tai ilman DEHP:tä), polyolefiinista (polypropeeni ja/tai polyeteeni) tai etyleenivinyyliasetaatista (EVA) valmistettua säiliötä.
- Kääntele infuusiosäiliötä varovasti ylösalaisin laimennetun liuoksen sekoittamiseksi. Älä ravista.
- Laimennettu liuos on käytettävä heti, sitä voidaan säilyttää huoneenlämmössä (20–25 °C) tai jääkaapissa (2–8 °C). Enimmäisaika valmisteen käyttökuntoon saattamisesta annon lopettamiseen on 8 tuntia, josta enintään 4 tuntia käyttökuntoon saattamisen ja laimentamisen välillä. Herkkä valolle. Ei saa jäätyä.
Anto:
- Jos laimennettua liuosta säilytetään jääkaapissa (2–8 °C), liuoksen on annettava lämmetä huoneenlämpöön (20–25 °C) noin 1 tunnin ajan ennen antoa.
- Laimennettua liuosta ei tarvitse suodattaa. Jos laimennettu liuos kuitenkin suodatetaan, suositellaan polyeetterisulfoni (PES)-, polyvinyylideenifluoridi (PVDF)- tai hydrofiilisiä polysulfoni (HPS) -suodattimia. Älä käytä nylonista tai selluloosaesteristä (MCE) valmistettuja suodattimia.
- Suojaa infuusiopussi infuusion aikana valolta käyttämällä ultraviolettivalolta suojaavaa suojusta (esim. meripihkanväristä, tummanruskeaa tai vihreää pussia tai alumiinifoliota). Infuusioletkua ei tarvitse suojata valolta.
- Anna laimennettu liuos 1 tunnin infuusiona nopeudella 50 ml/h huoneenlämmössä (20–25 °C). Herkkä valolle. Infuusioletkuiksi suositellaan PVC:stä (DEHP:tä sisältävä tai ilman DEHP:tä), polyolefiinista (polypropeeni ja/tai polyeteeni) tai polybutadieenista valmistettuja letkuja.
Älä sekoita tai infusoi BESPONSA-valmistetta muiden lääkevalmisteiden kanssa.
BESPONSA-valmisteen säilytysajat ja ‑olosuhteet käyttökuntoon saattamista, laimentamista ja antoa varten on esitetty seuraavassa.
Käyttökuntoon saatetun ja laimennetun BESPONSA-valmisteen säilytysajat ja ‑olosuhteet

a Enintään 4 tuntia käyttökuntoon saattamisen ja laimentamisen välillä.
Säilytysolosuhteet ja kestoaika
Avaamattomat injektiopullot
5 vuotta.
Käyttökuntoon saatettu liuos
BESPONSA ei sisällä bakteriostaattisia säilytysaineita. Käyttökuntoon saatettu liuos on käytettävä heti. Jos käyttökuntoon saatettua liuosta ei voida käyttää heti, sitä voidaan säilyttää jääkaapissa (2–8 °C) enintään 4 tuntia. Herkkä valolle. Ei saa jäätyä.
Laimennettu liuos
Laimennettu liuos on käytettävä heti, tai sitä voidaan säilyttää huoneenlämmössä (20–25 °C) tai jääkaapissa (2–8 °C). Enimmäisaika valmisteen käyttökuntoon saattamisesta annon lopettamiseen on 8 tuntia, josta enintään 4 tuntia käyttökuntoon saattamisen ja laimentamisen välillä. Herkkä valolle. Ei saa jäätyä.