CRYSVITA 10 mg injektioneste, liuos
CRYSVITA 20 mg injektioneste, liuos
CRYSVITA 30 mg injektioneste, liuos
burosumabi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä CRYSVITA on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät CRYSVITA-valmistetta
3. Miten CRYSVITA-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. CRYSVITA-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Mitä CRYSVITA on
CRYSVITA-valmisteen sisältämä vaikuttava aine on burosumabi. Se kuuluu lääkkeisiin, joita kutsutaan ihmisen monoklonaalisiksi vasta-aineiksi.
Mihin CRYSVITA-valmistetta käytetään
CRYSVITA-valmistetta käytetään X‑kromosomaalisen hypofosfatemian hoitoon. Sitä käytetään 1–17‑vuotiaille lapsille ja nuorille sekä aikuisille.
CRYSVITA-valmistetta käytetään tuumoriosteomalasian hoitoon, kun tämän sairauden aiheuttavaa kasvainta (tuumoria) ei voida poistaa tai paikantaa, 1–17-vuotiailla lapsilla ja nuorilla ja aikuisilla.
Mitä X-kromosomaalinen hypofosfatemia on
X‑kromosomaalisen hypofosfatemia on perinnöllinen sairaus.
- Sitä sairastavien henkilöiden elimistössä on tavallista enemmän fibroblastikasvutekijä 23:ksi (FGF23) kutsuttua hormonia.
- FGF23 pienentää fosfaatin pitoisuutta veressä.
- Alhainen fosfaattipitoisuus saattaa
- estää lasten ja nuorten luita kasvamasta kunnolla
- estää lasten, nuorten ja aikuisten luita kovettumasta kunnolla
- aiheuttaa luiden ja nivelten kipua ja jäykkyyttä kaikilla potilailla.
Mitä tuumoriosteomalasia on
- Tuumoriosteomalasiaa sairastavilla henkilöillä on tavallista suurempi määrä hormonia nimeltä FGF23, jota tietyntyyppiset kasvaimet (tuumorit) tuottavat.
- FGF23 alentaa fosfaatin määrää veressä.
- Alhainen fosfaattipitoisuus voi johtaa luiden pehmenemiseen, lihasheikkouteen, väsymykseen, luukipuun ja murtumiin.
Miten CRYSVITA vaikuttaa
CRYSVITA kiinnittyy FGF23:een veressä ja estää sitä vaikuttamasta. Tämä suurentaa veren fosfaattipitoisuutta, jolloin voidaan saavuttaa normaali fosfaattipitoisuus.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä CRYSVITA-valmistetta
- jos olet allerginen burosumabille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos otat fosfaattiravintolisiä tai tiettyjä D‑vitamiiniravintolisiä (jotka sisältävät niin kutsuttua aktiivista D‑vitamiinia, esim. kalsitriolia)
- jos veresi fosfaattipitoisuus on ennestään suuri (hyperfosfatemia)
- jos sinulla on vaikea munuaissairaus tai munuaisten vajaatoiminta.
Allergiset reaktiot
Lopeta CRYSVITA-valmisteen ottaminen ja ota heti yhteys lääkäriin, jos sinulla esiintyy seuraavia haittavaikutuksia, sillä ne saattavat olla merkkejä allergisesta reaktiosta:
- ihottuma ja kutina ympäri kehoa
- silmäluomien, suun tai huulten voimakas turvotus (angioedeema)
- hengenahdistus
- nopea sydämensyke
- hikoilu.
Jos jokin edellä mainituista koskee sinua, älä ota CRYSVITA-valmistetta. Jos olet epävarma, keskustele lääkärin kanssa ennen CRYSVITA-valmisteen käyttöä.
Varoitukset ja varotoimet
Ihoreaktiot
Pistoskohdan ihoreaktiot ovat mahdollisia; ks. lisätietoja kohdasta Mahdolliset haittavaikutukset. Jos reaktiot ovat voimakkaita, käänny lääkärin puoleen.
Kokeet ja tutkimukset
Hoidon aikana lääkäri seuraa veresi ja virtsasi fosfaatti- ja kalsiumpitoisuuksia ja saattaa myös tehdä munuaisten ultraäänitutkimuksia. Näiden tarkoitus on vähentää veren liiallisen fosfaattipitoisuuden (hyperfosfatemian) ja kalsiumin kudoksiin, esimerkiksi munuaisiin, kerääntymisen (ektooppisen mineralisaation) riskiä. Myös seerumisi lisäkilpirauhashormonin pitoisuus tarkistetaan ajoittain.
Alle 1-vuotiaat lapset
CRYSVITA-valmistetta ei pidä antaa alle 1‑vuotiaille lapsille, sillä lääkkeen turvallisuutta ja vaikutuksia ei ole tutkittu tässä ikäryhmässä.
Muut lääkevalmisteet ja CRYSVITA
Kerro lääkärille, jos parhaillaan otat, olet äskettäin ottanut tai saatat ottaa muita lääkkeitä.
Älä ota CRYSVITA-valmistetta ja kerro lääkärille, jos otat:
- fosfaattiravintolisiä
- tiettyjä D‑vitamiiniravintolisiä (jotka sisältävät niin kutsuttua aktiivista D‑vitamiinia, esim. kalsitriolia). Tiettyjen D‑vitamiiniravintolisien käytön jatkaminen tai aloittaminen on sallittua, ja lääkäri kertoo sinulle, mitkä ne ovat.
Keskustele lääkärin kanssa ennen kuin otat CRYSVITA-valmistetta:
- jos otat lääkkeitä, jotka vaikuttavat kalsiumin lailla elimistössä (kalsimimeettejä). Samanaikaisesti käytettynä ne saattavat alentaa veren kalsiumpitoisuutta.
- jos olet tuumoriosteomalasiaa sairastava potilas ja saat hoitoa taustalla olevaan kasvaimeen (eli sädehoito tai poisto leikkauksella). Siinä tapauksessa CRYSVITA-hoitoa ei aloiteta, ennen kuin taustalla oleva kasvain on poistettu, eikä silloin, jos seerumin fosfaattipitoisuus on alhainen.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä. CRYSVITA-valmisteen vaikutusta lapseen ei tunneta.
CRYSVITA-valmisteen käyttöä ei suositella raskauden aikana.
Jos voit tulla raskaaksi, sinun on käytettävä tehokasta ehkäisyä CRYSVITA-valmisteen käytön aikana. Keskustele asiasta lääkärin kanssa.
Ei tiedetä, kulkeutuuko CRYSVITA-valmistetta rintamaitoon, eikä vastasyntyneeseen tai imeväiseen kohdistuvia riskejä voida poissulkea. Keskustele asiasta lääkärin kanssa.
Ajaminen, pyöräily ja koneiden käyttö
CRYSVITA-valmiste saattaa aiheuttaa huimausta ja siten vaikuttaa pyöräilykykyyn, työkalujen käyttökykyyn tai ajokykyyn. Jos tunnet huimausta, älä pyöräile, käytä työkaluja tai aja, ja kerro asiasta lääkärille.
CRYSVITA sisältää sorbitolia
Tämä lääkevalmiste sisältää 45,91 mg sorbitolia per injektiopullo, joka vastaa 45,91 mg:aa/ml.
3. Miten valmistetta käytetään
CRYSVITA-valmiste annetaan pistoksena ihon alle olkavarteen, vatsaan, pakaraan tai reiteen. Terveydenhuollon ammattilainen antaa tämän lääkkeen sinulle tai lapsellesi. Vaihtoehtoisesti lääkäri saattaa suositella, että annat pistoksen itsellesi tai lapsellesi itse. Terveydenhuollon ammattilainen opettaa, miten pistos annetaan. Hoitoa aloitettaessa ja aina annosta muutettaessa sinun on annettava ensimmäinen pistos terveydenhuollon ammattilaisen läsnä ollessa. Tämän pakkausselosteen lopussa on yksityiskohtainen käyttöohje. Noudata sitä huolellisesti aina, kun annat itsellesi tai lapsellesi CRYSVITA-pistoksen.
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai sairaanhoitaja tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä, sairaanhoitajalta tai apteekista, jos olet epävarma.
Kuinka paljon CRYSVITA-valmistetta tarvitset
Annos määräytyy painosi mukaan. Lääkäri laskee oikean annoksen sinulle.
Annos X-kromosomaaliseen hypofosfatemiaan ja tuumoriosteomalasiaan
CRYSVITA-annos on pistettävä
- 1–17‑vuotiaille lapsille ja nuorille kahden viikon välein
- aikuisille neljän viikon välein.
Lääkäri varmistaa kokeiden avulla, että annoksesi on oikean suuruinen, ja annostasi tai annostiheyttä saatetaan tarvittaessa muuttaa.
Suurin mahdollinen annos X-kromosomaalista hypofosfatemiaa sairastaville potilaille
Suurin mahdollinen annos X-kromosomaalisen hypofosfatemian hoitoon on 90 mg.
Suurin mahdollinen annos tuumoriosteomalasiaa sairastaville potilaille
Suurin mahdollinen annos tuumoriosteomalasian hoitoon:
- 1–12-vuotiaille lapsille on 90 mg
- 13–17-vuotiaille nuorille ja aikuisille on 180 mg
Tuumoriosteomalasiaa sairastavat potilaat
Jos olet tuumoriosteomalasiaa sairastava potilas ja tarvitset hoitoa taustalla olevaan kasvaimeen (eli sädehoito tai poisto leikkauksella), lääkäri keskeyttää CRYSVITA-hoidon. Kun kasvaimen hoito on saatu päätökseen, lääkäri tarkistaa fosfaattiarvosi ja aloittaa CRYSVITA-hoidon uudelleen, jos seerumin fosfaattipitoisuus on alhainen.
Jos sinulle on annettu enemmän CRYSVITA-valmistetta kuin pitäisi
Kerro heti lääkärille, jos epäilet saaneesi liikaa CRYSVITA-valmistetta.
Jos CRYSVITA-annos jää väliin
Jos annos jää väliin, käänny heti lääkärin puoleen. Väliin jäänyt annos tulee antaa mahdollisimman pian, ja lääkäri järjestää tulevat annokset uudelleen sen mukaisesti.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Haittavaikutukset X-kromosomaalista hypofosfatemiaa sairastavilla lapsilla ja nuorilla
Hyvin yleiset (saattaa esiintyä useammalla kuin yhdellä lapsella ja nuorella 10:stä)
- hammasinfektion aiheuttama märkäpesäke (hammasabsessi)
- yskä
- päänsärky
- huimaus
- oksentelu
- pahoinvointi
- ripuli
- ummetus
- hammaskaries tai hampaiden reikiintyminen
- ihottuma
- kipu lihaksissa, käsissä ja jaloissa
- pistoskohdan reaktiot, joita voivat olla:
- punoitus tai ihottuma
- kipu tai kutina
- turvotus
- verenvuoto tai mustelma.
Nämä pistoskohdan reaktiot ovat yleensä lieviä ja ilmenevät vuorokauden sisällä pistoksesta. Ne paranevat yleensä noin 1–3 vuorokaudessa.
- kuume
- alhainen veren D‑vitamiinipitoisuus.
Tuntemattomat (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin):
- veren fosfaattipitoisuuden suurentuminen
Haittavaikutukset tuumoriosteomalasiaa sairastavilla lapsilla ja nuorilla
Haittavaikutuksia lapsilla ja nuorilla ei tunneta, koska kliinisiä tutkimuksia ei ole tehty.
Haittavaikutukset X-kromosomaalista hypofosfatemiaa ja tuumoriosteomalasiaa sairastavilla aikuisilla
Hyvin yleiset (saattaa esiintyä useammalla kuin yhdellä aikuisella 10:stä)
- hammasinfektion aiheuttama märkäpesäke (absessi)
- päänsärky
- huimaus
- pakottava jalkojen liikuttelemisen tarve epämukavien, kivuliaiden tai outojen tuntemusten välttämiseksi jaloissa, etenkin ennen nukahtamista tai yön aikana (levottomien jalkojen oireyhtymä)
- ummetus
- selkäkipu
- lihaskouristukset
- pistoskohdan reaktiot, joita voivat olla kipu tai turvotus
- alhainen veren D-vitamiinipitoisuus
Yleiset (saattaa esiintyä enintään yhdellä aikuisella 10:stä)
- ihottuma
- veren fosfaattipitoisuuden suurentuminen
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä CRYSVITA-valmistetta kotelossa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2–8 °C). Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Älä käytä CRYSVITA-valmistetta, jos siinä näkyy hiukkasia.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Näin menetellen suojelet luontoa.
Jos pistät lääkkeen itse, katso pakkauselosteen lopusta ”Käyttöohje”-kohdan vaiheessa 5 olevat ohjeet käyttämättömien lääkkeiden ja tarvikkeiden hävittämisestä.
Jos sinulla on kysymyksiä käyttämättömien lääkkeiden hävittämisestä, käänny terveydenhuoltohenkilökunnan tai apteekkihenkilökunnan puoleen.
6. Pakkauksen sisältö ja muuta tietoa
Mitä CRYSVITA sisältää
Vaikuttava aine on burosumabi. Yksi injektiopullo sisältää 10, 20 tai 30 mg burosumabia.
Muut aineet ovat L‑histidiini, D‑sorbitoli (E420), polysorbaatti 80, L‑metioniini, suolahappo, 10 %, ja injektionesteisiin käytettävä vesi. (Ks. lisätietoja kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”CRYSVITA sisältää sorbitolia”).
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
CRYSVITA on kirkas tai hieman opalisoiva, väritön tai vaalean kellanruskea injektioneste pienessä lasisessa injektiopullossa. Pakkaus sisältää yhden injektiopullon.
Myyntiluvan haltija
Kyowa Kirin Holdings B.V.
Bloemlaan 2
2132NP Hoofddorp
Alankomaat
medinfo@kyowakirin.com
Valmistaja
allphamed PHARBIL Arzneimittel GmbH
Hildebrandstr. 10-12
37081 Göttingen
Saksa
Kyowa Kirin Holdings B.V.
Bloemlaan 2
2132NP Hoofddorp
Alankomaat
Tämä pakkausseloste on tarkistettu viimeksi helmikuu 2024
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu. Siellä on myös linkkejä muille harvinaisia sairauksia ja niiden hoitoja käsitteleville verkkosivuille.
Ohjeet käyttäjälle
Lue tämä käyttöohje huolellisesti, ennen kuin käytät CRYSVITA-valmistetta:
- Anna pistos itsellesi tai lapsellesi vain, jos lääkäri on kehottanut sinua tekemään niin.
- Anna pistos itse vasta sen jälkeen, kun sinut on opetettu antamaan se. Hoitoa aloitettaessa ja aina annosta muutettaessa sinun on annettava ensimmäinen pistos terveydenhuollon ammattilaisen läsnä ollessa.
- Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta tai sairaanhoitaja (terveydenhuollon ammattilaisia) on neuvonut. Tarkista ohjeet terveydenhuollon ammattilaiselta, jos olet epävarma.
- Lääkäri määrää sinulle oikean annoksen. Annos mitataan milligrammoina (mg). CRYSVITA on saatavilla injektiopulloissa kolmena eri vahvuutena: 10 mg, 20 mg ja 30 mg. Kaikki injektiopullot ovat kertakäyttöisiä. Käytä aina kuhunkin pistokseen uutta CRYSVITA-injektiopulloa; ks. jäljempänä olevasta vaiheesta 5 ohjeet käytettyjen injektiopullojen ja muiden tarvikkeiden hävittämisestä.
- Terveydenhuollon ammattilainen kertoo sinulle, kuinka paljon CRYSVITA-valmistetta sinun pitää antaa itsellesi tai lapsellesi. Sinulle tai lapsellesi saatetaan antaa useampi kuin yksi injektiopullo oikeaa annosta varten.
- Jos terveydenhuollon ammattilainen kertoo sinulle, että annokseesi tarvitaan useampi kuin yksi pistos, sinun on toistettava vaiheet 2–5 kullekin pistokselle. Käytä kuhunkin pistokseen uusia tarvikkeita ja eri ihoaluetta.
- Käytä pistoksen antamiseen vain terveydenhuollon ammattilaisen antamia tai määräämiä ruiskuja ja neuloja.
- Vedä neste injektiopullosta aina isolla neulalla, ja muista vaihtaa pieneen neulaan nesteen pistämistä varten.
- Väärän ruiskun tai neulan käyttö voi aiheuttaa annostusvirheen tai tehdä pistoksesta kivuliaamman.
- Jos CRYSVITA-valmistetta annetaan pienelle lapselle, toisen henkilön läsnäolosta ja tuesta saattaa olla apua.
- Älä käytä CRYSVITA-valmistetta, jos olet allerginen tämän lääkkeen jollekin aineelle. Jos saat allergisen reaktion pistoksen aikana tai sen jälkeen, lopeta CRYSVITA-valmisteen käyttö ja ota välittömästi yhteys lääkäriin. Ks. lisätietoja pakkausselosteen kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä.
Vaihe 1. Kerää ja tarkista tarvikkeet
Ota tarvitsemasi CRYSVITA-injektiopullot jääkaapista.
Tarkista vahvuus kunkin injektiopullon etiketistä.
Varmista, että sinulla on oikea määrä injektiopulloja, joka vastaa annostasi milligrammoina terveydenhuollon ammattilaisen ohjeiden mukaisesti.
Jos olet epävarma, tarkista ohjeet terveydenhuollon ammattilaiselta.
Anna injektiopullojen lämmetä huoneenlämmössä 30 minuutin ajan. Älä lämmitä injektiopulloja millään muulla tavalla, kuten kuumalla vedellä tai mikroaaltouunissa. Älä aseta injektiopulloja suoraan auringonvaloon.
Tarkista injektiopullon etiketissä oleva viimeinen käyttöpäivämäärä (lyhenteen EXP jälkeen).
Tarkasta injektiopullossa oleva neste. Älä ravista.
Älä käytä injektiopulloa
- viimeisen käyttöpäivämäärän jälkeen
- jos neste on poikkeavan väristä, sameaa tai siinä näkyy hiukkasia. CRYSVITA-nesteen pitää olla kirkasta tai hieman opalisoivaa ja väritöntä tai vaalean kellanruskeaa.
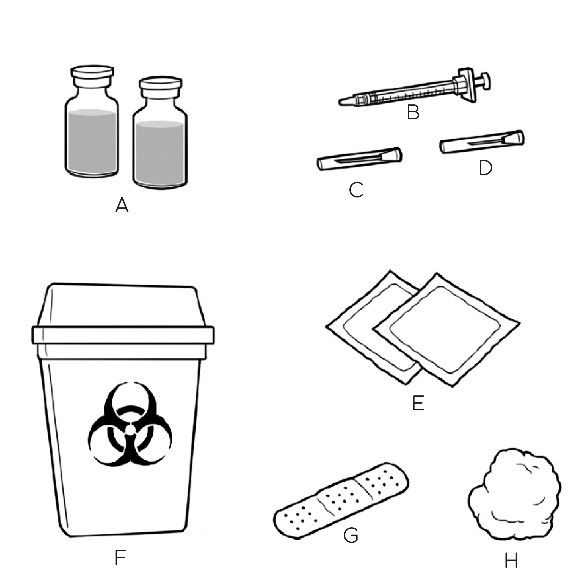 | Aseta kaikki tarvitsemasi tarvikkeet puhtaalle, tasaiselle alustalle. Kutakin pistosta kohden tarvitaan: A. CRYSVITA-injektiopullo pistosta (pistoksia) varten B. Yksi männällinen ruisku C. Yksi iso neula CRYSVITA-valmisteen vetämiseen injektiopullosta D. Yksi pieni neula CRYSVITA-valmisteen pistämiseen E. Alkoholipyyhkeitä F. Teräville esineille tarkoitettu jäteastia G. Laastaria (jos tarpeen) H. Harsotaitoksia tai vanutuppoja Ota yhteys terveydenhuollon ammattilaiseen, jos sinulla ei ole näitä tarvikkeita. |
Terveydenhuollon ammattilainen selittää sinulle, miten eri neuloja käytetään.
Isoa neulaa käytetään CRYSVITA-valmisteen vetämiseen injektiopullosta.
Pientä neulaa käytetään CRYSVITA-valmisteen pistämiseen.
Jos olet epävarma, tarkista ohjeet terveydenhuollon ammattilaiselta ennen käyttöä.
Älä käytä tarvikkeita, joista puuttuu osia tai jotka ovat jollakin tapaa vaurioituneita.
Älä poista neulansuojuksia neuloista, ennen kuin olet valmis käyttämään neuloja.
Pese kätesi huolellisesti saippualla ja vedellä, ennen kuin siirryt vaiheeseen 2.
Vaihe 2. Vedä CRYSVITA-valmiste injektiopullosta ja valmistele pistos
Poista injektiopullon sinettikorkki, jolloin injektiopullon kumitulppa tulee näkyviin.
Puhdista kumitulppa alkoholipyyhkeellä ja anna kuivua. Älä koske kumitulppaan puhdistamisen jälkeen.
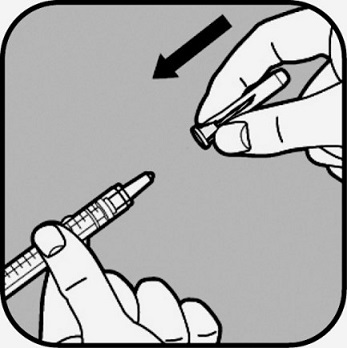 | Poista iso neula steriilistä pakkauksestaan, mutta älä irrota sen neulansuojusta. Pidä toisella kädellä isoa neulaa neulansuojuksesta ja toisella kädellä ruiskua säiliöstä, ja kiinnitä neula ruiskuun. Kiinnitä neula saamiesi tarvikkeiden mukaisesti - joko painamalla neulaa ruiskuun ja kääntämällä neulaa myötäpäivään, kunnes se on tiukasti kiinni
- tai painamalla neulaa ruiskuun, kunnes se on tiukasti kiinni.
Älä koske itse neulaan tai ruiskun päähän, johon neula kiinnittyy. |
Kun neula on tiukasti kiinnitetty, pitele ruiskua säiliöstä niin, että neula osoittaa ylöspäin.
Poista neulansuojus vetämällä se suoraan irti.
Älä hävitä neulansuojusta.
Älä koske neulaan tai anna neulan koskettaa mitään pintaa sen jälkeen, kun neulansuojus on poistettu.
Älä käytä ruiskua, jos tiputat sen neulansuojuksen irrottamisen jälkeen tai jos neula näyttää vaurioituneelta.
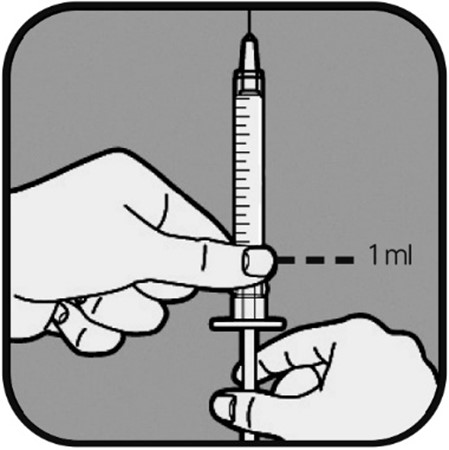 | Terveydenhuollon ammattilainen kertoo sinulle, kuinka paljon nestettä sinun pitää pistää. Määrä on normaalisti 1 ml kutakin pistosta kohden. Jos sinun on pistettävä vähemmän kuin 1 ml, terveydenhuollon ammattilainen näyttää sinulle, mitä merkkiviivaa sinun kuuluu käyttää. Käytä aina annostasi vastaavaa merkkiviivaa. Jos olet epävarma, tarkista ohjeet terveydenhuollon ammattilaiselta ennen käyttöä. Vedä ruiskun mäntää taaksepäin, kunnes männän pää on annostasi vastaavan merkkiviivan kohdalla. Tämä täyttää ruiskun ilmalla. |
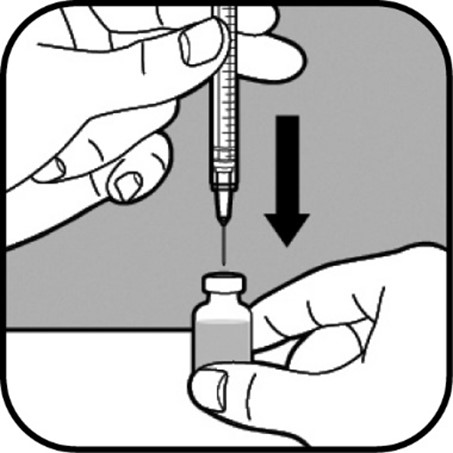 | Pidä injektiopullo tasaista alustaa vasten. Työnnä iso neula hitaasti kumitulpan läpi injektiopulloon. Neulan kärjen ei pidä koskettaa injektiopullossa olevaa nestettä. Jos neulan kärki koskettaa nestettä, vedä neulaa hitaasti takaisin, kunnes kärki ei enää kosketa nestettä. Työnnä mäntä hitaasti ruiskuun. Tämä työntää ruiskussa olevan ilman injektiopulloon. |
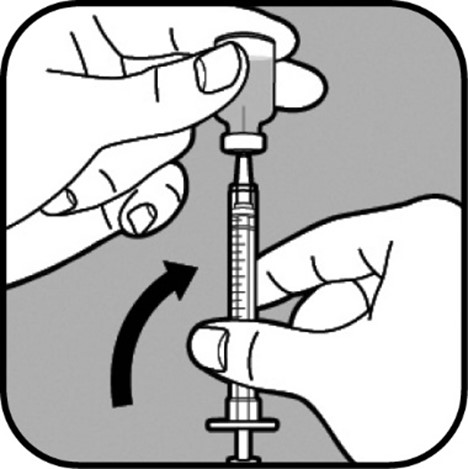 | Anna neulan olla injektiopullossa, ja käännä injektiopullo ylösalaisin. Varmista, että neulan kärki on nesteen pohjalla. |
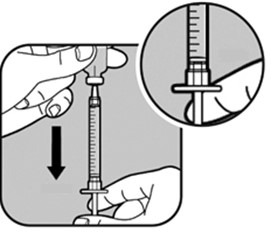 | Täytä ruisku vetämällä mäntää hitaasti taaksepäin, kunnes männän pää on annostasi vastaavan merkkiviivan kohdalla. Pidä neulan kärki jatkuvasti nesteessä. |
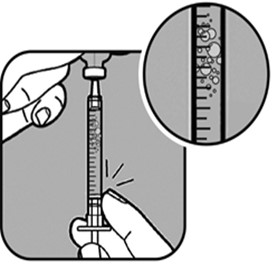 | Tarkista ruiskussa oleva neste ilmakuplien varalta. Jos havaitset kuplia, - pidä ruiskua pystysuorassa poistamatta neulaa injektiopullon sisältä,
- naputa säiliötä kevyesti sormella, jotta ilmakuplat liikkuvat,
- kun ilmakuplat ovat säiliön yläosassa, työnnä ne ulos painamalla mäntää hitaasti.
Tarkista annoksesi uudelleen ruiskun merkkiviivojen avulla. Vedä tarvittaessa ruiskuun lisää nestettä, jotta männän pää on annostasi vastaavan merkkiviivan kohdalla. Tarkista neste uudelleen ilmakuplien varalta, ja toista tarvittaessa edellä mainittu menettely. |
Kun ruiskussa ei näy kuplia, irrota ruisku ja neula injektiopullosta vetämällä suoraan alaspäin.
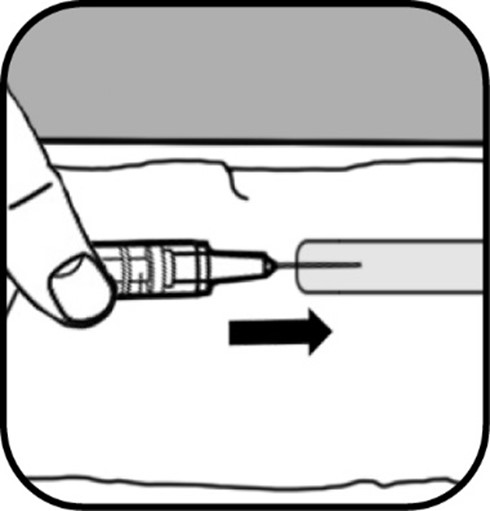 | Irrota iso neula ruiskusta seuraavasti: - Ota ison neulan neulansuojus ja aseta se tasaiselle alustalle.
- Työnnä iso neula yhtä kättä käyttäen neulansuojukseen ja kohota neulaa, jotta suojus peittää sen. Vammojen välttämiseksi älä käytä toista kättä apuna. Tartu sen jälkeen toisella kädellä suojukseen ja napsauta se paikalleen.
- Irrota iso neula ruiskusta saamiesi tarvikkeiden mukaisesti
- joko kiertämällä suojuksen peittämää neulaa vastapäivään
- tai vetämällä suojuksen peittämä neula suoraan irti ruiskusta. Aseta irrotettu neula teräville esineille tarkoitettuun jäteastiaan.
|
Poista pieni neula steriilistä pakkauksestaan, mutta älä irrota sen neulansuojusta.
Pidä toisella kädellä pientä neulaa neulansuojuksesta ja toisella kädellä ruiskua säiliöstä, ja kiinnitä neula ruiskuun.
Kiinnitä neula saamiesi tarvikkeiden mukaisesti
- joko painamalla neulaa ruiskuun ja kääntämällä neulaa myötäpäivään, kunnes se on tiukasti kiinni
- tai painamalla neulaa ruiskuun, kunnes se on tiukasti kiinni.
Älä koske itse neulaan tai ruiskun päähän, johon neula kiinnittyy.
Vaihe 3. Valmistele pistoskohta
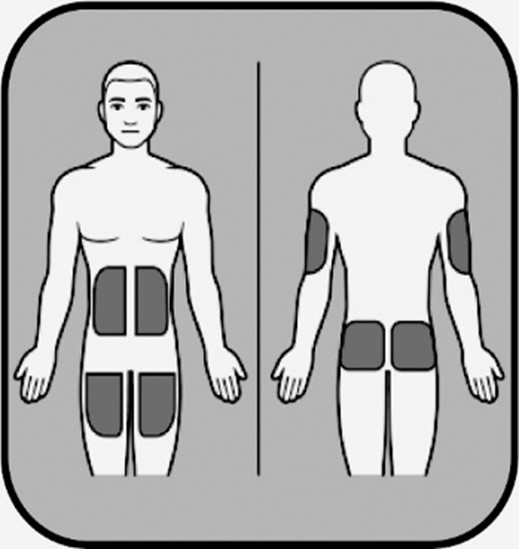 | Pistos on annettava ihon alla olevaan rasvakerrokseen. Valitse ihoalue pistokselle. Jos annat pistoksen itsellesi, sopivia alueita ovat: - vatsan alue, reisien yläosa.
Jos annat pistoksen toiselle henkilölle, sopivia alueita ovat: - vatsan alue, reisien yläosa, olkavarsien ulkosivu, pakarat.
Älä anna pistosta: - alueelle, joka aristaa, punoittaa, jossa on mustelma tai jossa iho on rikkoontunut
- alueelle, jossa on arpijuovia tai arpia (mukaan lukien palovammat)
- suoraan luomeen tai luomen ympäristöön.
|
Jos annat useamman kuin yhden pistoksen, käytä kullekin pistokselle eri ihoaluetta. Puhdista kukin pistoskohta uudella alkoholipyyhkeellä, ja anna ihon kuivua.
CRYSVITA on pistettävä puhtaaseen, kuivaan ihoon.
Vaihe 4. Pistä CRYSVITA
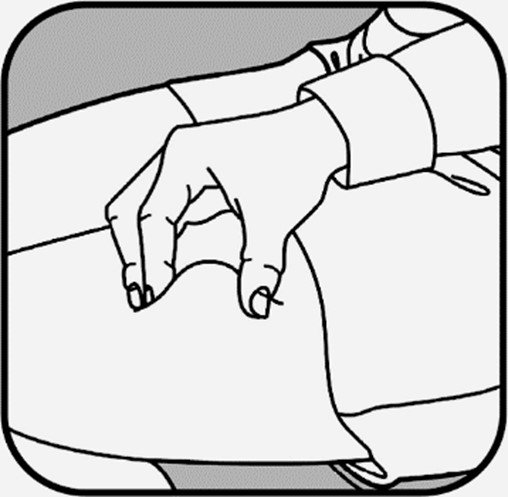 | Poista pienen neulan neulansuojus vetämällä se suoraan irti. Tartu ihoon niin, että peukalon ja muiden sormien väliin jää noin 5 cm leveä ihopoimu. Pidä ruiskua hallitsevan kätesi peukalon ja etusormen välissä. Neula on työnnettävä ihoon 45 asteen tai 90 asteen kulmassa. Terveydenhuollon ammattilainen näyttää sinulle, kumpaa kulmaa sinun pitää käyttää. |
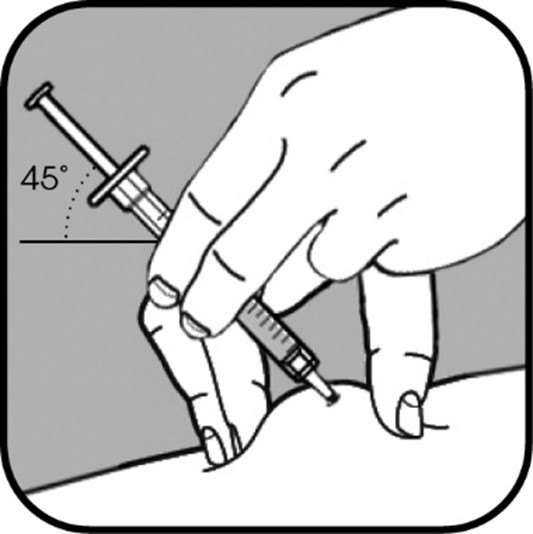 | 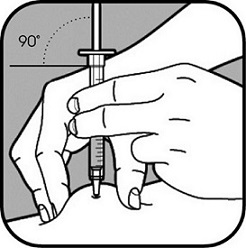 |
Työnnä neula ihopoimuun nopealla ja napakalla liikkeellä. Älä paina mäntää, kun työnnät neulan ihoon. |
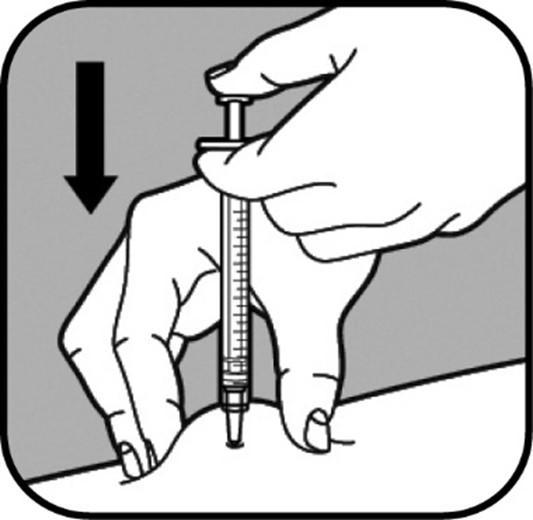 | Kun neula on ihossa, älä liikuta sitä. Jatka ihosta kiinni pitämistä. Työnnä mäntä hitaasti ruiskuun, enintään 30 sekunnin kuluessa, kunnes ruisku on tyhjä. |
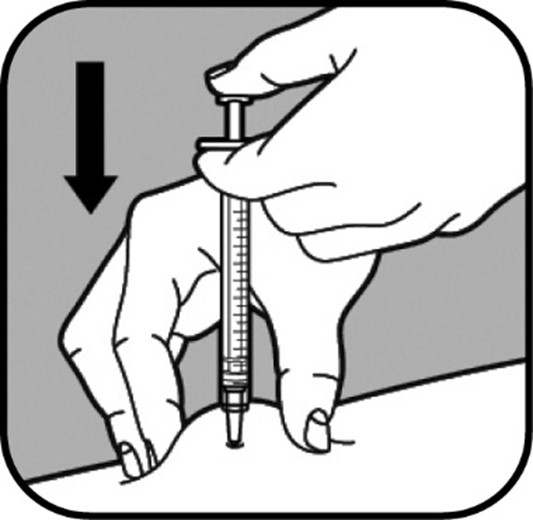 | Kun olet antanut koko annoksen, irrota neula vetämällä se varovaisesti suoraan irti ihosta. Päästä irti ihopoimusta. Paina pistoskohtaa vanutupolla tai harsotaitoksella muutaman sekunnin ajan verenvuodon tyrehdyttämiseksi. Kiinnitä tarvittaessa laastari. Älä hankaa pistoskohtaa. Vammojen välttämiseksi älä kiinnitä pienen neulan neulansuojusta takaisin neulaan. Aseta neula ilman suojusta teräville esineille tarkoitettuun jäteastiaan. |
Vaihe 5. Kunkin pistoksen jälkeen
Aseta käytetyt neulat, neulansuojukset ja ruiskut teräville esineille tarkoitettuun jäteastiaan. Injektiopullot on hävitettävä paikallisten suositusten mukaisesti.
Älä hävitä neuloja tai ruiskuja talousjätteiden mukana.
Älä säästä injektiopulloja, joissa on lääkettä jäljellä, tulevaa käyttöä varten äläkä anna niitä muiden käyttöön.
Kun teräville esineille tarkoitettu jäteastiasi on melkein täynnä, sinun on pyydettävä uusi astia ja hävitettävä vanha astia asianmukaisesti noudattamalla paikallisia suosituksia.
Muistutus: Jos annat useamman kuin yhden pistoksen, toista vaiheet 2–5 kullekin pistokselle.
Käytä kuhunkin pistokseen uusia tarvikkeita.
Merkitse muistiin pistosten päivämäärät ja kaikki pistoskohdat, jotta voit vaihtaa pistoskohtia seuraavalla kerralla.
Video, jossa näytetään, miten pistos valmistellaan ja annetaan, on saatavilla seuraavan linkin kautta: www.myinject.eu