Beovu 120 mg/ml injektioneste, liuos, esitäytetty ruisku
brolusitsumabi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Beovu on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Beovu-valmistetta
3. Miten Beovu-valmistetta annetaan
4. Mahdolliset haittavaikutukset
5. Beovu-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Mitä Beovu on
Beovun vaikuttava aine on brolusitsumabi, joka kuuluu uudissuonittumisen estoon käytettävien lääkkeiden lääkeryhmään. Lääkäri pistää Beovu‑lääkkeen silmään hoitaakseen silmäsairauksia, jotka voivat vaikuttaa näköön.
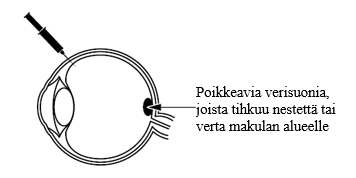
Poikkeavia verisuonia, joista tihkuu nestettä tai verta makulan alueelle
Mihin Beovua käytetään
Beovua käytetään silmäsairauksien hoitoon aikuisille, kun makula-alueen eli silmän takaosassa olevan tarkan näön alueen alla esiintyy poikkeavaa verisuonimuodostusta ja verisuonikasvua. Poikkeavat verisuonet voivat olla hauraita ja niistä voi tihkua nestettä tai verta silmään. Tämä voi huonontaa makulan toimintaa ja aiheuttaa mahdollisesti näköä heikentäviä silmäsairauksia, kuten:
- kostea silmänpohjan ikärappeuma (AMD)
- diabeettinen makulaturvotus (DME).
Miten Beovu vaikuttaa
Beovu voi hidastaa taudin etenemistä ja siten ylläpitää tai jopa parantaa näköäsi.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle ei saa antaa Beovu-valmistetta
- jos olet allerginen brolusitsumabille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos silmässä tai silmän ympäristössä on aktiivinen infektio tai epäillään olevan infektio.
- jos silmässä on kipua tai punoitusta (tulehdusreaktio silmässä).
Jos jokin näistä koskee sinua, kerro siitä lääkärille. Sinulle ei saa antaa Beovua.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin sinulle annetaan Beovu-valmistetta, jos jokin seuraavista koskee sinua:
- jos sinulla on glaukooma (silmäsairaus, joka yleensä johtuu korkeasta silmänpaineesta).
- jos olet aiemmin nähnyt valonvälähdyksiä tai lasiaiskellujia (näkökentässä kelluvia tummia täpliä) ja jos kellujien koko ja määrä suurenevat äkisti.
- jos sinulle on tehty silmäleikkaus edeltävien neljän viikon aikana tai jos sinulle aiotaan tehdä silmäleikkaus seuraavien 4 viikon kuluessa.
- jos sinulla on aiemmin ollut silmätauteja tai olet aiemmin saanut silmän hoitoja.
- jos edeltävän vuoden aikana olet äkillisesti menettänyt näkösi silmän takaosan verisuonten tukkeutumisen (verkkokalvon verisuonitukos) vuoksi tai sinulla on ollut silmän takaosan verisuonten tulehdus (verkkokalvon vaskuliitti).
Kerro heti lääkärille, jos:
- sinulle ilmaantuu silmän punoitusta, silmän kipua, aiempaa voimakkaampaa epämukavaa tunnetta, pahenevaa silmän punoitusta, näön sumenemista tai näön heikkenemistä, aiempaa enemmän pieniä hiukkasia näkökentässä, lisääntyvää valoherkkyyttä.
- menetät näkösi äkillisesti, mikä voi olla merkki verkkokalvon verisuonitukoksesta.
Lääkäri voi lopettaa Beovu-hoitosi, jos sinulle ilmaantuu mikä tahansa yllämainituista oireista.
Sinun on tärkeää tietää myös, että:
- Beovun turvallisuutta ja tehoa ei ole tutkittu sellaisessa tapauksessa, että sitä annettaisiin molempiin silmiin samanaikaisesti ja sellaisessa käytössä haittavaikutusten riski voi olla suurempi.
- Beovu-pistokset saattavat aiheuttaa silmänpaineen kohoamista (silmänsisäinen paine) joillekin potilaille 30 minuutin sisällä pistoksesta. Lääkärisi tarkkailee silmänpainettasi jokaisen pistoksen jälkeen.
- lääkärisi tarkistaa onko sinulla muita riskitekijöitä, jotka voivat lisätä silmän takaosan eri kerrosten repeämän tai irtauman mahdollisuutta (verkkokalvon irtauma tai repeämä, verkkokalvon pigmenttisolukerroksen irtauma tai repeämä). Beovun annossa on noudatettava varovaisuutta, jos riskitekijöitä on.
Koko elimistöön vaikuttavien (systeemisten) VEGF-kasvutekijän estäjälääkkeiden käyttöön, joiden vaikuttava aine on samantyyppinen kuin Beovu-valmisteessa, voi liittyä riski verisuonia tukkivien verihyytymien (valtimoiden tromboemboliatapahtumat) muodostumiseen. Nämä voivat johtaa sydäninfarktiin tai aivohalvaukseen. Silmään annetun Beovu-pistoksen jälkeen on olemassa teoreettinen riski tällaisten tapahtumien ilmaantumiseen.
Lapset ja nuoret
Beovua ei käytetä lasten eikä alle 18-vuotiaiden nuorten hoitoon.
Muut lääkevalmisteet ja Beovu
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen kuin sinulle annetaan tätä lääkettä.
Imetys ei ole suositeltavaa Beovu‑hoidon aikana eikä ennen kuin Beovu-hoidon lopettamisesta on kulunut vähintään yksi kuukausi. Ei näet tiedetä, erittyykö Beovu ihmisen rintamaitoon.
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisymenetelmää Beovu-hoidon aikana ja vähintään yhden kuukauden ajan Beovu-hoidon lopettamisen jälkeen. Kerro heti lääkärille, jos tulet hoidon aikana raskaaksi tai epäilet olevasi raskaana. Beovua ei saa käyttää raskauden aikana, ellei hoidon mahdollinen hyöty ylitä syntymättömään lapseen mahdollisesti kohdistuvia riskejä.
Ajaminen ja koneiden käyttö
Beovu-pistoksen jälkeen sinulla voi olla ohimeneviä näköhäiriöitä (esim. näön sumenemista). Älä aja ajoneuvoja äläkä käytä koneita ennen kuin nämä oireet ovat hävinneet.
Beovu sisältää natriumia
Tämä lääke sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Beovu sisältää polysorbaatteja
Tämä lääke sisältää 0,01 mg polysorbaatti 80:tä per annos (0,05 ml). Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
3. Miten valmistetta käytetään
Annettava Beovu-annos ja antotiheys
Suositeltu annos on 6 mg brolusitsumabia.
Kostea silmänpohjan ikärappeuma
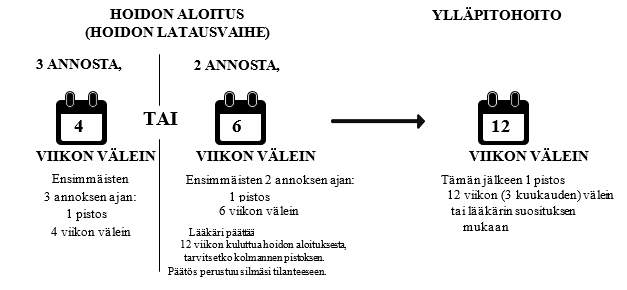
Hoidon aloitus (jota kutsutaan myös hoidon latausvaiheeksi)
- Saat yhden pistoksen kuukaudessa ensimmäisten 3 kuukauden ajan.
- Vaihtoehtoisesti voit saada yhden pistoksen 6 viikon välein ensimmäisten 2 annoksen ajan. Lääkäri päättää 12 viikon kuluttua hoidon aloituksesta, tarvitsetko kolmannen pistoksen. Päätös perustuu silmäsi/silmiesi tilanteeseen.
Ylläpitohoito
- Tämän jälkeen voit saada yhden pistoksen 3 kuukauden välein. Lääkäri määrää hoitovälin silmäsi tilanteen perusteella. Jotkut potilaat saattavat tarvita hoitoa 2 kuukauden välein. Silmäsi kunnosta riippuen lääkäri voi pidentää tai lyhentää hoitoväliä enintään yhdellä kuukaudella kerrallaan. Yli 5 kuukauden hoitoväleistä on rajallisesti tietoa. Kahden Beovu-annoksen väli ei saa olla lyhyempi kuin 2 kuukautta.
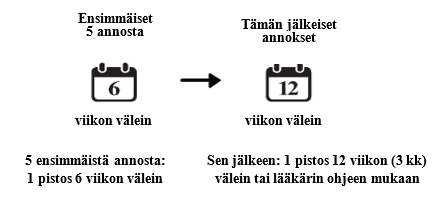
Diabeettinen makulaturvotus
- Saat yhden pistoksen 6 viikon välein ensimmäisten 5 pistoksen ajan.
- Tämän jälkeen voit saada yhden pistoksen 3 kuukauden välein. Lääkäri määrää hoitovälin silmäsi tilanteen perusteella. Jotkut potilaat saattavat tarvita hoitoa 2 kuukauden välein. Jotkut potilaat taas saattavat saada hoitoa 4 kuukauden välein.
Antotapa
Silmälääkäri antaa Beovu-pistoksen silmääsi (silmän lasiaiseen).
Ennen pistosta lääkäri puhdistaa silmän huolellisesti infektioiden ehkäisemiseksi. Lääkäri tiputtaa silmään myös paikallispuudutesilmätippaa, joka puuduttaa silmän ja vähentää tai estää pistoksen aiheuttamaa kipua.
Beovu-hoidon kesto
Beovua käytetään pitkäaikaisten silmäsairauksien hoitoon, joten myös hoito on pitkäkestoista. Hoito saattaa jatkua kuukausia tai vuosia. Lääkäri tarkistaa säännöllisten sovittujen käyntien aikana, että hoito toimii. Lääkäri voi tutkia silmiäsi myös pistosten välillä. Jos sinulla on kysyttävää Beovu-hoidon kestosta, käänny hoitavan lääkärin puoleen.
Ennen Beovu-hoidon lopettamista
Keskustele hoitavan lääkärin kanssa ennen hoidon lopettamista. Hoidon lopettaminen voi suurentaa näön menetyksen riskiä, ja näkökykysi voi huonontua.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Beovu-pistoksen haittavaikutukset tulevat joko itse lääkkeestä tai pistostoimenpiteestä, ja niitä esiintyy lähinnä silmässä.
Jotkin haittavaikutukset voivat olla vakavia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on mitään seuraavista oireista, jotka ovat allergisten reaktioiden, tulehdusten tai infektioiden merkkejä:
- näön äkillinen heikkeneminen tai muuttuminen
- kipu, lisääntynyt epämukavuuden tunne, paheneva silmän punoitus
Jos sinulla on vakavia haittavaikutuksia, kerro asiasta heti lääkärille.
Muut mahdolliset haittavaikutukset
Jäljempänä luetellaan muita haittavaikutuksia, joita voi esiintyä Beovu-hoidon jälkeen.
Useimmat haittavaikutukset ovat lieviä tai keskivaikeita, ja ne häviävät yleensä viikon kuluessa kustakin pistoksesta.
Jos nämä haittavaikutukset muuttuvat vaikeiksi, kerro asiasta lääkärille.
Yleiset: voi esiintyä enintään 1 potilaalla 10:stä
- silmän seinämän keskikerroksen tulehdus (uveiitti eli suonikalvoston tulehdus)
- lasiaisen irtauma (lasiainen on silmän sisällä oleva geelimäinen aine)
- verkkokalvon repeämä (silmän takaosassa oleva valoa havainnoiva alue) tai erään verkkokalvon kudoskerroksen repeämä (verkkokalvon pigmenttiepiteelin repeämä)
- näöntarkkuuden heikentyminen
- verkkokalvoverenvuoto
- tulehdus värikalvossa, eli silmän värillisessä osassa (iriitti)
- värikalvon ja sitä ympäröivä silmäkudoksen tulehdus (iridosykliitti)
- äkillinen näön menetys, joka johtuu silmän takaosassa sijaitsevien verisuonten tukkeutumisesta (verkkokalvon verisuonitukos)
- verenvuoto silmän sisällä (lasiaisen verenvuoto)
- mykiön samentuminen (kaihi)
- verenvuoto silmän pintakerroksen (sidekalvon) pienistä verisuonista
- näkökentässä liikkuvat täplät (lasiaiskellujat, ”hyttystanssi”)
- silmäkipu
- silmänsisäisen paineen nousu
- silmän valkoisen osan punoitus (sidekalvotulehdus)
- näön sumentuminen tai epätarkkuus
- sarveiskalvon naarmuuntuminen (abraasio; sarveiskalvo on silmän värikalvon edessä oleva kirkas kudoskerros)
- sarveiskalvon vaurio (pistemäinen sarveiskalvotulehdus; sarveiskalvo on silmän värikalvon edessä oleva kirkas kudoskerros)
- allergiset reaktiot (yliherkkyys)
Melko harvinaiset: voi esiintyä enintään 1 potilaalla 100:sta
- silmän sisäosien vaikea tulehdus (endoftalmiitti)
- sokeus
- äkillinen näön menetys silmän valtimotukoksen vuoksi (verkkokalvovaltimon tukos)
- verkkokalvon irtauma
- silmän punoitus (sidekalvon verekkyys)
- lisääntynyt kyynelnesteen eritys (lisääntynyt kyynelvuoto)
- poikkeava tunne silmässä
- verkkokalvon tietyn kudoskerroksen irtauma (verkkokalvon pigmenttiepiteelin irtauma)
- lasiaisen tulehdus (vitriitti; lasiainen on silmän sisällä oleva geelimäinen aine)
- silmän etuosan tulehdus (etukammion tulehdus tai valotie)
- sarveiskalvon turvotus (sarveiskalvo on silmän kirkas kudoskerros)
- silmän takaosassa sijaitsevien verisuonten tulehdus (verkkokalvon vaskuliitti)
- silmän kovakalvon tulehdus (skleriitti; kovakalvo on silmän valkoinen ulkokerros)
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Pidä esitäytetty ruisku sinetöidyssä kuplapakkauksessa ja ulkopakkauksessa. Herkkä valolle.
Avaamatonta kuplapakkausta ja siinä olevaa esitäytettyä ruiskua voidaan säilyttää huoneenlämmössä (alle 25 °C) enintään 24 tunnin ajan ennen käyttöä.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Beovu sisältää
- Vaikuttava aine on brolusitsumabi. Yksi ml liuosta sisältää 120 mg brolusitsumabia. Yksi esitäytetty ruisku sisältää 19,8 mg brolusitsumabia 0,165 millilitrassa liuosta. Tämä määrä riittää yhteen 0,05 ml:n kerta-annokseen liuosta, joka sisältää 6 mg brolusitsumabia.
- Muut aineet ovat: natriumsitraatti, sakkaroosi, polysorbaatti 80, natriumhydroksidi (pH:n säätöä varten), injektionesteisiin käytettävä vesi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Lääkevalmisteen kuvaus ja pakkauskoko
Beovu 120 mg/ml injektioneste (liuos) esitäytetyssä ruiskussa (injektio) on kirkas tai hieman opaalinhohtoinen, väritön tai hieman ruskeankellertävä vesiliuos.
Pakkauskoko: 1 esitäytetty ruisku vain kertakäyttöön.
Myyntiluvan haltija
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlanti
Valmistaja
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Belgia
Novartis Pharma GmbH
Roonstraße 25
90429 Nürnberg
Saksa
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Tämä pakkausseloste on tarkistettu viimeksi 19.5.2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu
Ohjeet terveydenhuollon ammattilaiselle
Esitäytetyn ruiskun käyttöohjeet
Säilytys ja tarkastus
Beovun valmistelu ja anto
Esitäytetty ruisku sisältää suositeltua 6 mg:n annosta suuremman annoksen. Esitäytetystä ruiskusta vedettävissä olevaa tilavuutta (0,165 ml) ei saa käyttää kokonaan. Liuosylimäärä on poistettava ennen injektiota. Esitäytetyn ruiskun koko liuosmäärän injisointi voi johtaa yliannokseen.
Injektiotoimenpide silmän lasiaiseen on toteutettava aseptisissa olosuhteissa. Tähän sisältyy kirurginen käsien desinfiointi ja steriilien käsineiden, steriilin liinan ja steriilin luomilevittimen (tai vastaavan) käyttö. Saatavilla on oltava steriilit parasenteesivälineet (mikäli tarpeen).
Ennen injektiota silmänympärysiho, silmäluomi ja silmän pinta desinfioidaan laajakirjoisella paikallisella mikrobisidilla ja annetaan riittävä puudutus.
Silmän lasiaiseen annettavan injektion yhteydessä käytetään steriiliä injektioneulaa, jonka koko on 30G x ½”. Injektioneula ei kuulu Beovu-pakkaukseen.
Varmista, että injektio annetaan välittömästi annoksen valmistelun jälkeen (vaihe 5).
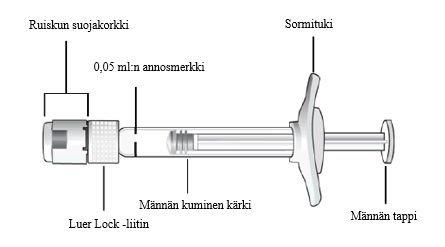
Huom. Annokseksi on asetettava 0,05 ml.
Injektiotoimenpide
| 1. | Repäise ruiskun kuplapakkauksen kansi pois ja ota ruisku aseptisesti laatikosta. |
2. 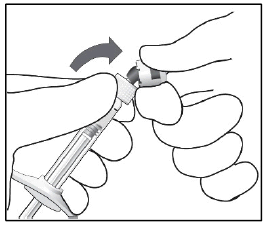
| Napsauta ruiskun suojakorkki irti (älä käännä äläkä kierrä). |
| 3. | Kiinnitä injektioneula (30G x ½”) ruiskuun aseptisesti ja tukevasti. |
4. 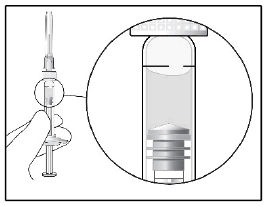
| Pitele ruiskua neula ylöspäin ja tutki ruisku ilmakuplien varalta. Jos ruiskussa on kuplia, naputa ruiskua varovasti sormella, kunnes kuplat nousevat ruiskun yläosaan. Poista varovasti neulansuojus vetämällä se suoraan pois. |
5. 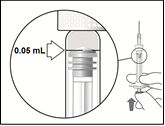
| Nosta ruisku silmiesi korkeudelle ja paina varovasti mäntää, kunnes männän kuperan kumisen kärjen reuna on 0,05 ml:n annosmerkin kohdalla. Näin ruiskussa oleva ilma ja liuosylimäärä poistuvat ja annokseksi tulee 0,05 ml. Ruisku on valmis injektiota varten. |
| 6. | Injisoi liuosta hitaasti, kunnes männän kuminen kärki koskettaa ruiskun pohjaa ja silmään on siirtynyt 0,05 ml:n annos. Tarkista, että männän kuminen kärki koskettaa ruiskun runko-osan pohjaa. Näin varmistat, että koko annos on annettu. |
Huom. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Usein kysyttyä
K: Entä jos kaikkien ilmakuplien poistaminen nesteestä ei onnistu?
V: On tärkeää, että nesteen seassa ei ole ilmaa. Männän kärkeen tarttuneet pienenpienet ilmakuplat eivät kuitenkaan yleensä irtoa männän kärjestä lääkkeen injisoinnin aikana, joten ne eivät vaikuta annoksen tilavuuteen.