WILFACTIN 500 IU injektiokuiva-aine ja liuotin, liuosta varten
WILFACTIN 1000 IU injektiokuiva-aine ja liuotin, liuosta varten
WILFACTIN 2000 IU injektiokuiva-aine ja liuotin, liuosta varten
ihmisen von Willebrand -tekijä
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä WILFACTIN on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät WILFACTIN-valmistetta
3. Miten WILFACTIN-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. WILFACTIN-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
WILFACTIN on valmistettu ihmisen plasmasta (veren nestemäinen osa), ja se sisältää vaikuttavaa ainetta, joka on nimeltään ihmisen von Willebrand -tekijä (VWF).
Von Willebrand -tekijä osallistuu veren hyytymiseen. Kun tämä tekijä puuttuu, kuten von Willebrandin taudissa, veri ei hyydy riittävän nopeasti, mikä aiheuttaa kohonneen alttiuden verenvuodoille. Von Willebrand -tekijän korvaaminen WILFACTIN-valmisteella auttaa tilapäisesti korjaamaan veren hyytymismekanismeja.
WILFACTIN-valmiste on tarkoitettu leikkauksesta johtuvan tai muun verenvuodon ehkäisemiseen ja hoitoon von Willebrandin tautia sairastaville silloin, kun desmopressiinihoito (DDAVP) ei yksinään käytettynä tehoa tai sen antaminen on vasta-aiheista.
WILFACTIN-valmistetta voidaan käyttää kaikille ikäryhmille.
WILFACTIN-valmistetta ei saa käyttää A-hemofilian hoitoon.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä WILFACTIN-valmistetta
- jos olet allerginen ihmisen von Willebrand ‑tekijälle tai WILFACTIN-valmisteen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on A-hemofilia.
Varoitukset ja varotoimet
Veren hyytymishäiriöihin perehtyneen lääkärin tulee valvoa WILFACTIN-hoitoa.
Jos sinulla ilmenee runsasta verenvuotoa ja verikokeiden perusteella hyytymistekijä VIII:n pitoisuus on pienentynyt, saat von Willebrand -tekijän lisäksi hyytymistekijä VIII:aa 12 ensimmäisen tunnin aikana.
Allergiset reaktiot
Kaikkien laskimoon annettavien ihmisen verestä tai plasmasta valmistettujen proteiinilääkkeiden yhteydessä voi ilmetä yliherkkyysreaktioita allergian muodossa.
Sinua tarkkaillaan injektion aikana yliherkkyysreaktion varhaisten merkkien varalta. Yliherkkyysreaktion ensimerkkejä ovat ihottuma (nokkosrokko tai yleistynyt urtikaria), puristava tunne rinnassa, hengityksen vinkuminen, verenpaineen lasku (hypotensio) ja vaikeat allergiset reaktiot (anafylaksia).
Lääkäri kertoo sinulle allergisten reaktioiden varoitusmerkeistä.
Jos yliherkkyyden oireita tai löydöksiä ilmenee, hoito on lopetettava ja sinun on hakeuduttava välittömästi lääkärin hoitoon.
Virusturvallisuus
Kun lääkkeitä valmistetaan ihmisen verestä tai plasmasta, infektioiden siirtyminen potilaille ehkäistään tietyin toimenpitein. Näitä toimenpiteitä ovat:
- veren ja plasman luovuttajien huolellinen valinta, millä varmistetaan, etteivät luovuttajat ole mahdollisia taudinkantajia
- jokaisen luovutuserän ja plasmapoolin tutkiminen viruksiin tai infektioihin viittaavien merkkien varalta
- veren tai plasman käsittely vaiheittain niin, että virukset tehdään tehottomiksi tai ne poistetaan.
Näistä toimenpiteistä huolimatta infektion siirtymisen mahdollisuutta ei voida sulkea täysin pois, kun annetaan ihmisen verestä tai plasmasta valmistettuja lääkkeitä. Tämä koskee myös tuntemattomia tai uusia viruksia tai muun tyyppisiä infektioita.
Käytössä olevien toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten ihmisen immuunikatovirukseen (HIV-AIDS), hepatiitti B -virukseen ja hepatiitti C -virukseen.
Näiden toimenpiteiden teho voi olla rajallinen vaipattomiin viruksiin, kuten hepatiitti A -virukseen ja parvovirus B19:ään. Parvovirus B19 -infektio voi olla vakava raskaana oleville naisille (sikiön infektio) sekä tietyntyyppistä anemiaa (esim. sirppisolutauti tai hemolyyttinen anemia) tai immuunipuutosta sairastaville.
Rokotukset
Lääkäri voi suositella sinulle hepatiitti A- ja B- rokotuksia, jos saat ihmisen plasmasta valmistettua von Willebrand -tekijää säännöllisesti tai toistuvasti.
Eränumeron kirjaaminen
On erittäin suositeltavaa, että aina kun saat WILFACTIN-valmistetta, valmisteen nimi ja eränumero kirjataan muistiin, jotta tiedot kaikista käytetyistä lääke-eristä ovat tarvittaessa olemassa.
Verisuonen tukosriski
Verisuonet voivat tukkeutua verihyytymien (tromboosien) vuoksi.
Verisuonitukosten riski on olemassa erityisesti silloin, jos sinulla on tiettyjä riskitekijöitä sairaushistoriasi tai aiempien laboratoriokokeiden tulosten perusteella.
Tällöin sinua seurataan hyvin huolellisesti verisuonitukosten varhaisvaiheen merkkien varalta. Lisäksi aloitetaan verihyytymien aiheuttamien verisuonitukosten estohoito.
Kun käytetään hyytymistekijä VIII:aa sisältävää von Willebrand -tekijävalmistetta, lääkärin tulee olla tietoinen siitä, että tällaisen hoidon jatkaminen voi aiheuttaa hyytymistekijä VIII:n pitoisuuden liiallista nousua. Jos saat hyytymistekijä VIII:aa sisältävää von Willebrand -tekijävalmistetta, lääkärin on tarkkailtava hyytymistekijä VIII:n pitoisuutta plasmassa säännöllisesti. Näin varmistetaan, että hyytymistekijä VIII:n pitoisuus plasmassa ei kohoa liikaa, koska se voisi aiheuttaa verisuonitukosten riskin.
Hoidon riittämätön teho
On mahdollista, että von Willebrandin tautia, erityisesti tyyppiä 3, sairastavilla muodostuu proteiineja, jotka tekevät von Willebrand -tekijän tehottomaksi. Näitä proteiineja kutsutaan neutraloiviksi vasta-aineiksi tai estäjiksi. Jos laboratoriotulokset osoittavat, että von Willebrand ‑tekijän pitoisuus ei pysy yllä tai jos verenvuoto ei lakkaa riittävästä WILFACTIN-annoksesta huolimatta, lääkäri tarkistaa, onko elimistössäsi von Willebrand -tekijän estäjiä. Jos estäjiä esiintyy suurina pitoisuuksina, von Willebrand -tekijähoito ei välttämättä ole tehokas ja on harkittava muita hoitovaihtoehtoja. Veren hyytymishäiriöihin perehtynyt lääkäri aloittaa uuden hoidon.
Muut lääkevalmisteet ja WILFACTIN
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
WILFACTIN-valmistetta tulee käyttää raskauden ja imetyksen aikana vain, jos se on selvästi aiheellista.
WILFACTIN-valmisteen käyttöä ei ole tutkittu raskaana olevilla tai imettävillä naisilla. Eläinkokeet eivät ole riittäviä takaamaan valmisteen turvallisuutta hedelmällisyyden, raskauden tai lapsen kehityksen kannalta raskauden aikana ja sen jälkeen.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
Vaikutuksia ajokykyyn tai koneiden käyttökykyyn ei ole havaittu.
WILFACTIN sisältää natriumia
Yksi 5 ml:n WILFACTIN-injektiopullo (500 IU) sisältää 0,15 mmol (3,4 mg) natriumia.
Tämä vastaa 0,17 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Yksi 10 ml:n WILFACTIN-injektiopullo (1000 IU) sisältää 0,3 mmol (6,9 mg) natriumia.
Tämä vastaa 0,35 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Yksi 20 ml:n WILFACTIN-injektiopullo (2000 IU) sisältää 0,6 mmol (13,8 mg) natriumia.
Tämä vastaa 0,69 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
3. Miten valmistetta käytetään
Hoito aloitetaan ja annetaan hyytymishäiriöiden hoitoon perehtyneen lääkärin seurannassa.
Jos lääkärisi on sitä mieltä, että voit käyttää hoitoa kotona, saat lääkäriltä asianmukaiset ohjeet.
Annos
Ota tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Suositellaan, että WILFACTIN-valmisteen antaa lääkäri tai sairaanhoitaja. Jos sinulle on kuitenkin määrätty WILFACTIN-valmiste kotona käytettäväksi, lääkärisi varmistaa, että sinulle näytetään, miten injektio annetaan ja kuinka suuri annos tulee antaa. Noudata lääkärin antamia ohjeita ja pyydä apua, jos sinulla on ongelmia ruiskun käsittelyssä. Ruiskua saa käyttää vain sen käyttöön koulutettu henkilö.
Lääkäri laskee tarvitsemasi WILFACTIN-annoksen (ilmaistaan kansainvälisinä yksikköinä, IU).
Annos riippuu:
- ruumiinpainosta
- verenvuotokohdasta
- verenvuodon voimakkuudesta
- kliinisestä terveydentilasta
- tarvittavasta leikkauksesta
- von Willebrand -tekijän aktiivisuudesta veressä leikkauksen jälkeen
- sairautesi vaikeusasteesta.
Annos on 40-80 IU/kg.
Lääkäri suosittelee verikokeiden ottamista hoidon aikana, jotta voidaan seurata:
- hyytymistekijä VIII:n pitoisuutta (F VIII:C)
- von Willebrand ‑tekijän pitoisuutta (VWF:RCo)
- vasta-aineiden ilmaantumista
- verihyytymien muodostumiseen viittaavien varhaisvaiheen merkkien ilmaantumista, jos sinulla on tällaisten komplikaatioiden vaara.
Näiden kokeiden tulosten perusteella lääkäri saattaa päättää muuttaa sinulle annettavien injektioiden annostusta ja antoväliä.
Tietyissä tapauksissa voi olla tarpeen antaa WILFACTIN-valmisteen lisäksi hyytymistekijä VIII ‑valmistetta (toinen veren hyytymiseen vaikuttava valkuaisaine), jotta verenvuoto voidaan estää tai hoitaa nopeammin (hätätilanteissa tai jos ilmenee äkillistä verenvuotoa).
WILFACTIN-valmistetta voidaan antaa myös pitkäkestoisena estolääkityksenä. Myös tällöin annos määritetään yksilöllisesti. WILFACTIN-valmistetta annetaan 40–60 IU/kg kahdesta kolmeen kertaa viikossa verenvuotojen määrän vähentämiseksi.
Käyttö lapsilla ja nuorilla
Annostus lapsille ja nuorille perustuu kehon painoon. Joissakin tapauksissa, erityisesti nuoremmilla potilailla (alle 6-vuotiailla), voidaan tarvita suurempia annoksia (enintään 100 IU/kg).
Kerro lääkärille, jos WILFACTIN-valmisteen teho tuntuu sinusta liian voimakkaalta tai liian heikolta.
Antotapa
Tarkat ohjeet tämän lääkevalmisteen käyttökuntoon saattamiseen ja antamiseen ovat pakkausselosteen lopussa.
Jos käytät enemmän WILFACTIN-valmistetta kuin sinun pitäisi
WILFACTIN-valmisteen yliannostuksen aiheuttamia oireita ei ole ilmoitettu.
Verisuonitukoksen riskiä ei kuitenkaan voida sulkea pois merkittävän yliannostuksen yhteydessä.
Jos unohdat käyttää WILFACTIN-valmistetta
Jos unohdat käyttää WILFACTIN-valmistetta, kerro siitä lääkärille.
Älä ota kaksinkertaista annosta korvataksesi unohtamasi annoksen.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, WILFACTIN-valmistekin voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Ota heti yhteyttä lääkäriin, jos
- havaitset yliherkkyyden tai allergisen reaktion oireita (melko harvinaisia: voi esiintyä enintään yhdellä henkilöllä sadasta).
Joissakin tapauksissa allerginen reaktio voi edetä vaikeaksi (anafylaksia), ja se voi aiheuttaa anafylaktisen sokin (esiintyvyys tuntematon).
Allergisen reaktion varoitusmerkkejä ovat:
- hengitys- ja nielemisvaikeudet
- hengityksen vinkuminen
- puristava tunne rintakehässä
- sydämen lyöntien kiihtyminen
- verenpaineen lasku
- pyörtyminen
- voimakas väsymys
- levottomuus, hermostuneisuus
- päänsärky
- vilunväristykset, paleleminen
- ihon punehtuminen, kuumat aallot
- kehon eri osien turvotus
- ihottuma, yleistynyt nokkosihottuma
- infuusiokohdan kuumotus ja pistely
- kihelmöinti
- oksentelu
- pahoinvointi.
| Jos sinulla on mikä tahansa näistä oireista, lopeta heti hoito ja ota yhteyttä lääkäriin, jotta asianmukainen hoito voidaan aloittaa reaktion tyypin ja vaikeusasteen mukaisesti. |
- jos havaitset, että lääke lakkaa tehoamasta kunnolla (verenvuoto ei lakkaa). Tämä voi johtua siitä, että elimistössä on muodostunut von Willebrand -tekijää estäviä vasta-aineita (esiintyvyys tuntematon).
Von Willebrandin tautia, erityisesti tyyppiä 3, sairastavilla voi muodostua proteiineja, jotka tekevät von Willebrand -tekijän tehottomaksi. Näitä proteiineja kutsutaan neutraloiviksi vasta-aineiksi tai estäjiksi. Lääkärien tulee tarkkailla huolellisesti von Willebrand -tekijällä hoitoa saavia potilaita vasta-aineiden muodostumisen varalta sekä kliinisesti että laboratoriokokein. Vasta-aineiden muodostuminen voi ilmetä riittämättömänä kliinisenä vasteena tai vaikeiden allergisten reaktioiden yhteydessä.
- jos havaitset puutteellista verenkiertoa raajoissa (esim. kylmät ja kalpeat raajat) tai tärkeissä elimissä (esim. voimakas rintakipu). Tämä voi johtua verihyytymien muodostumisesta verisuonissa (esiintyvyys tuntematon).
On olemassa verihyytymien (tromboosien) riski, erityisesti potilailla, joilla on tunnettuja riskitekijöitä. Von Villebrand -tekijän puutoksen korjaamisen jälkeen sinua tarkkaillaan verisuonitukoksen tai yleistyneen suonensisäisen hyytymisen ensi merkkien varalta. Saat verisuonitukosten estohoitoa tilanteissa, joissa verisuonitukoksen riski on kohonnut (leikkauksen jälkeen, vuodelevossa, hyytymisen estäjän tai fibrinolyyttisen entsyymin puutoksessa).
Verisuonitukoksen riski voi myös olla kohonnut, jos saat hyytymistekijä VIII:aa sisältävää von Willebrand -tekijävalmistetta, sillä hyytymistekijä VIII:n pitoisuus on tällöin jatkuvasti koholla.
Seuraavia haittavaikutuksia on havaittu yleisesti (voi esiintyä enintään 1 henkilöllä kymmenestä):
Seuraavia haittavaikutuksia on havaittu melko harvoin (voi esiintyä enintään 1 henkilöllä sadasta):
- heitehuimaus
- tuntoaistimuksen häiriö, heikentynyt tuntoaisti
- punoitus
- kutina
- painostava tunne
- vilunväristykset, paleleminen.
Seuraava muu haittavaikus on havaittu, ja sen esiintyvyys on tuntematon:
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä injektiopullon etiketissä ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen.
Säilytä alle 25 °C. Säilytä alkuperäispakkauksessa. Herkkä valolle.
Ei saa jäätyä.
Steriiliyden vuoksi valmiste on suositeltavaa käyttää välittömästi käyttökuntoon saattamisen jälkeen. Valmisteen on kuitenkin osoitettu säilyvän kemiallisesti ja fysikaalisesti stabiilina 24 tunnin ajan 25 °C:ssa.
Älä käytä tätä lääkettä, jos liuos on sameaa tai siinä on sakkaa.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä WILFACTIN sisältää
Vaikuttava aine on: ihmisen von Willebrand -tekijä (500 IU, 1000 IU tai 2000 IU) kansainvälisinä yksikköinä (IU) ilmaistuna ristosetiinikofaktorin aktiivisuuden (VWF:RCo) perusteella.
Yksi injektiopullo sisältää noin 100 IU ihmisen von Willebrand -tekijää, kun WILFACTIN-valmiste on liuotettu 5 millilitraan injektionesteisiin käytettävää vettä (500 IU), 10 millilitraan injektionesteisiin käytettävää vettä (1000 IU) tai 20 millilitraan injektionesteisiin käytettävää vettä (2000 IU).
Ennen albumiinin lisäämistä spesifinen aktiivisuus on suurempi tai yhtä suuri kuin 60 IU VWF:RCo/mg kokonaisproteiinia.
Muut aineet ovat:
Injektiokuiva-aine: ihmisen albumiini, arginiinihydrokloridi, glysiini, natriumsitraatti ja kalsiumklorididihydraatti.
Liuotin: injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko
WILFACTIN on valkoinen tai vaaleankeltainen injektiokuiva-aine tai mureneva kiinteä injektiokuiva-aine ja kirkas tai väritön liuotin, liuosta varten, jotka saatetaan käyttökuntoon injektionesteeksi, liuosta varten, siirtolaitteella.
WILFACTIN-valmisteen saatavana olevat pakkauskoot ovat 500 IU/5 ml, 1000 IU/10 ml ja 2000 IU/20 ml.
Käyttökuntoon saatettu liuoksen tulee olla kirkas tai hiukan opalisoiva, väritön tai hiukan kellertävä.
Myyntiluvan haltija ja valmistaja
LFB BIOMEDICAMENTS
3 Avenue des Tropiques
ZA de Courtaboeuf
91940 Les Ulis
RANSKA
Tällä lääkkeellä on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
Suomi: WILFACTIN
Ranska: WILFACTIN
Kreikka: WILFACTIN
Italia: WILFACTIN
Luxemburg: WILFACTIN
Alankomaat: WILFACTIN
Tämä pakkausseloste on tarkistettu viimeksi 19.01.2024
Ohjeet käyttäjälle
Annostus
Annos yksi IU/kg von Willebrand ‑tekijää suurentaa tavallisesti verenkierrossa olevan VWF:RCo:n pitoisuutta noin 0,02 IU/ml (2 %).
Hoidolla on tarkoitus saavuttaa VWF:RCo:n pitoisuus > 0,6 IU/ml (60 %) ja hyytymistekijä VIII:n (FVIII:C:n) pitoisuus > 0,4 IU/ml (40 %).
Hemostaasia ei voida varmistaa ennen kuin hyytymistekijä VIII:n (F VIII:C:n) pitoisuus on saavuttanut arvon 0,4 IU/ml (40 %). Yksinään injektiona annettu von Willebrand ‑tekijä saa aikaan maksimaalisen F VIII:C-pitoisuuden nousun vasta 6-12 tunnin kuluttua. Se ei korjaa F VIII:C-pitoisuutta heti. Jos potilaan hoitoa edeltävä F VIII:C-pitoisuus on alle tämän kriittisen arvon ja tilanne edellyttää verenvuodon nopeaa tyrehdyttämistä (verenvuodon hoitaminen, vakava loukkaantuminen tai hätäleikkaus), von Willebrand -tekijän ensimmäisen injektion yhteydessä tulee antaa hyytymistekijää VIII, jotta saavutetaan hemostaasin edellyttämä plasman F VIII:C-pitoisuus.
Jos F VIII:C-pitoisuuden välitön suurentaminen ei kuitenkaan ole tarpeen, esimerkiksi suunnitelluissa leikkauksissa tai silloin, kun F VIII:C:n hoitoa edeltävä pitoisuus riittää varmistamaan verenvuodon tyrehtymisen, lääkäri voi päättää, ettei tekijää VIII tarvitse antaa ensimmäisen von Willebrand ‑tekijää sisältävän injektion yhteydessä.
Ensimmäinen annos WILFACTIN-valmistetta verenvuodon tyrehdyttämiseen tai vamman hoitoon on 40–80 IU/kg yhdessä tarvittavan hyytymistekijä VIII ‑annoksen kanssa potilaan plasman hoitoa edeltävän F VIII:C-pitoisuuden perusteella laskettuna, jotta tarvittava F VIII:C-pitoisuus voidaan saavuttaa plasmassa juuri ennen toimenpidettä tai mahdollisimman pian vuodon alkamisen tai vaikean loukkaantumisen jälkeen. Leikkauksen yhteydessä ensimmäinen injektio annetaan tuntia ennen toimenpidettä.
WILFACTIN-hoitoa aloitettaessa annos 80 IU/kg voi olla tarpeen, etenkin 3‑tyypin von Willebrandin tautia sairastavilla potilailla, joilla riittävien pitoisuuksien ylläpitäminen saattaa vaatia suurempia annoksia kuin von Willebrandin taudin muiden tyyppien yhteydessä.
Elektiivisessä kirurgiassa WILFACTIN-hoito tulee aloittaa 12–24 tuntia ennen toimenpidettä, ja toinen annos annetaan ennen toimenpidettä. Tässä tapauksessa hyytymistekijää VIII ei tarvitse antaa samanaikaisesti, koska endogeenisen F VIII:C:n pitoisuus on tavallisesti saavuttanut kriittisen arvon 0,4 IU/ml (40 %) ennen toimenpidettä. Tämä on kuitenkin varmistettava kunkin potilaan osalta.
Hoitoa tulee tarvittaessa jatkaa WILFACTIN-valmisteella yksinään yhtenä tai kahtena injektiona annoksella 40–80 IU/kg vuorokaudessa yhden tai useiden päivien ajan. Annostus ja antoväli sovitetaan aina leikkauksen tyypin, potilaan kliinisen ja biologisen statuksen (VWF:RCo ja F VIII:C) sekä vuodon tyypin ja vaikeusasteen mukaan.
- Pitkäkestoinen estolääkitys:
WILFACTIN-valmistetta voidaan antaa potilaalle yksilöllisesti sovitettuina annoksina pitkäaikaisena estohoitona. WILFACTIN-annos 40–60 IU/kg 2–3 kertaa viikossa vähentää vuotokertojen määrää.
Kotihoito voidaan aloittaa lääkärin ohjeen mukaan erityisesti vähäisessä tai kohtalaisessa verenvuodossa tai pitkäkestoisessa estohoidossa verenvuodon ehkäisemiseksi.
Lapset:
Kunkin käyttöaiheen mukainen annostus perustuu painoon. Annos ja hoidon kesto on sovitettava potilaan kliiniseen tilaan sekä plasman VWF:RCo- ja FVIII:C-pitoisuuksiin.
- Hoidon aloitus:
- Alle 6-vuotiailla lapsilla aloitusannos voi perustua potilaan vaiheittaiseen saantoon (IR) tai, jos IR-tietoja ei ole saatavilla, voidaan tarvita aloitusannoksena 60–100 IU/kg tavoitteena nostaa potilaan VWF:RCo-taso arvoon 100 IU/dl.
- Yli 6-vuotiaille lapsille ja nuorille annostus on sama kuin aikuisille potilaille.
- Seuraavat injektiot:
Lapsilla ja nuorilla myöhemmät annokset on valittava kliinisen tilan ja vWF:RCo-tasojen mukaan ja sovitettava kliiniseen vasteeseen.
- Elektiiviset leikkaukset:
- Alle 6-vuotiaiden lasten elektiivisessä leikkauksessa voidaan antaa uusinta-annos 30 minuuttia ennen toimenpidettä, kun ensimmäinen annos on annettu 12-24 tuntia ennen toimenpidettä.
- Yli 6-vuotiaille lapsille ja nuorille annostus on sama kuin aikuisille potilaille.
- Profylaksia:
Lapsilla ja nuorilla annos ja uudelleen antamisen tiheys on sovitettava yksilöllisesti potilaan vaiheittaisen toipumisen ja vWF:RCo-tasojen mukaan sekä sovitettava kliiniseen vasteeseen.
Antotapa
Laskimoon.
Käyttökuntoon saattaminen
Noudata aseptista toimintatapaa koskevia voimassa olevia ohjeita. Siirtolaitetta käytetään ainoastaan lääkkeen käyttökuntoon saattamiseen alla kuvatulla tavalla. Sitä ei ole tarkoitettu lääkkeen antamiseen potilaalle.
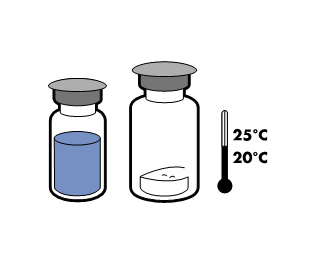 | - Ota injektiopullot (kuiva-aine ja liuotin) huoneenlämpöön (alle 25 °C).
|
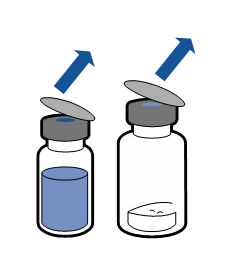 | - Poista liuotinpullon (injektionesteisiin käytettävä vesi) sekä kuiva-ainepullon suojakorkit.
- Desinfioi kummankin tulpan pinta.
|
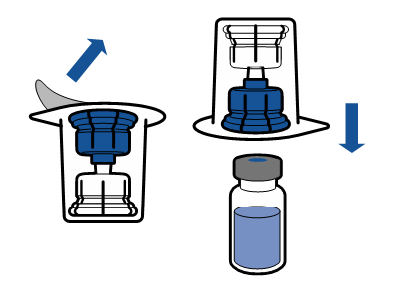 | - Poista Mix2Vial-laitteen suojakorkki. Kiinnitä Mix2vial-laitteen sininen pää liuotinpullon tulppaan poistamatta laitetta pakkauksesta.
|
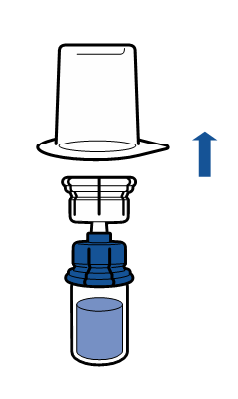 | - Poista pakkaus ja heitä se pois. Varo koskemasta laitteen suojaamattomaan osaan.
|
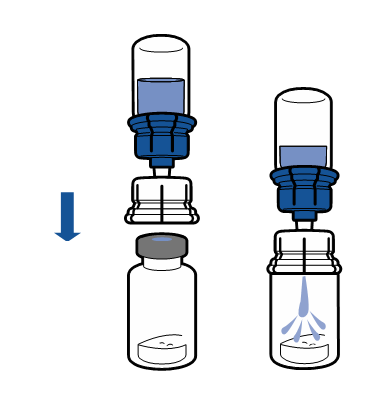 | - Käännä liuotinpullon ja laitteen yhdistelmä ympäri ja kiinnitä se kuiva-ainepulloon laitteen läpinäkyvän pään avulla. Liuotin siirtyy automaattisesti kuiva-ainepulloon. Pyörittele laitetta varovasti käsissäsi, kunnes kuiva-aine on täysin liuennut.
|
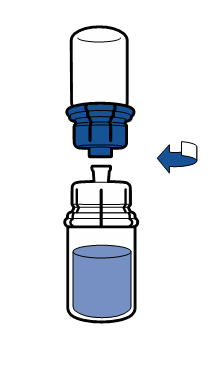
| - Pidä tämän jälkeen liuotetun tuotteen sisältävä injektiopullo toisessa kädessäsi ja liuotinpullo toisessa kädessäsi, ja irrota injektiopullot toisistaan kiertämällä Mix2Vial-laite irti.
|
Injektiokuiva-aine liukenee yleensä heti, ja sen pitäisi olla liuennut alle 5 minuutissa.
Liuoksen tulee olla kirkasta tai hieman opalisoivaa, väritöntä tai hieman kellertävää. Käyttökuntoon saattettu valmiste pitää tarkistaa ennen antoa silmämääräisesti, ettei siinä ole hiukkasia eikä värimuutoksia. Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa.
Liuosta ei saa sekoittaa muiden lääkkeiden kanssa.
Älä laimenna käyttökuntoon saatettua valmistetta.
Anto
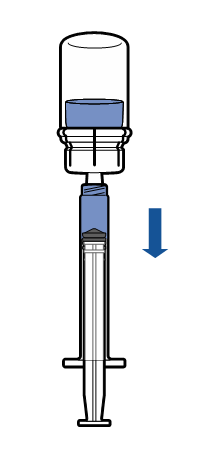 | - Pidä liuotetun tuotteen sisältämä injektiopullo pystysuorassa asennossa, ja kierrä steriili ruisku kiinni Mix2Vial-laitteeseen. Vedä tuote hitaasti ruiskuun.
- Kun tuote on vedetty ruiskuun, pidä ruiskusta tukevasti kiinni (mäntä alaspäin), irrota Mix2Vial-laite ja vaihda tilalle laskimoneula tai siipineula.
- Poista ruiskusta ilma ja pistä neula laskimoon sen jälkeen, kun olet desinfioinut ihon.
- Anna injektio hitaasti laskimoon kerta-annoksena välittömästi liuottamisen jälkeen. Enimmäisantonopeus on 4 ml/minuutti.
|
Säilytys käyttökuntoon saattamisen jälkeen
Steriiliyden vuoksi valmiste on käytettävä heti käyttökuntoon saattamisen jälkeen.
Valmisteen on kuitenkin osoitettu säilyvän käytön aikana kemiallisesti ja fysikaalisesti stabiilina 24 tunnin ajan +25 °C:ssa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.