ReFacto AF 250 IU injektiokuiva-aine ja liuotin, liuosta varten, esitäytetyssä ruiskussa
ReFacto AF 500 IU injektiokuiva-aine ja liuotin, liuosta varten, esitäytetyssä ruiskussa
ReFacto AF 1000 IU injektiokuiva-aine ja liuotin, liuosta varten, esitäytetyssä ruiskussa
ReFacto AF 2000 IU injektiokuiva-aine ja liuotin, liuosta varten, esitäytetyssä ruiskussa
ReFacto AF 3000 IU injektiokuiva-aine ja liuotin, liuosta varten, esitäytetyssä ruiskussa
moroktokogi alfa (rekombinantti ihmisen hyytymistekijä VIII)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä ReFacto AF on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät ReFacto AF -valmistetta
- Miten ReFacto AF -valmistetta käytetään
- Mahdolliset haittavaikutukset
- ReFacto AF -valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
ReFacto AF -valmisteen sisältämä vaikuttava aine on moroktokogi alfa, ihmisen hyytymistekijä VIII. Veressä hyytymistekijä VIII:a tarvitaan veren hyytymiseen ja verenvuodon loppumiseen. Hemofilia A -potilailla (synnynnäinen tekijä VIII:n puutos) ei ole hyytymistekijä VIII:a tai se ei toimi riittävästi.
ReFacto AF -valmistetta käytetään verenvuotojen hoitoon ja ehkäisyyn aikuisilla ja kaikenikäisillä lapsilla (mukaan lukien vastasyntyneet), joilla on hemofilia A.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä ReFacto AF -valmistetta
- jos olet allerginen moroktokogi alfalle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos olet allerginen hamsterin proteiineille.
Jos olet tästä epävarma, kysy lääkäriltäsi.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät ReFacto AF -valmistetta
- jos sinulla esiintyy allergisia reaktioita. Allergisten reaktioiden merkkejä voivat olla esimerkiksi hengitysvaikeudet, hengenahdistus, turvotus, nokkosihottuma, kutina, puristava tunne rinnassa, hengityksen vinkuna ja alhainen verenpaine. Anafylaksia on vakava allerginen reaktio, joka voi aiheuttaa nielemisvaikeuksia ja/tai hengitysvaikeuksia, punaiset ja turvonneet kasvot ja/tai kädet. Jos sinulla esiintyy mitä tahansa näistä merkeistä, lopeta infuusio heti ja ota yhteyttä lääkäriin tai hakeudu välittömästi ensiapuun. Vakavien allergisten reaktioiden tapauksessa tulee harkita vaihtoehtoista hoitoa.
- inhibiittorien (vasta-aineiden) muodostuminen on tunnettu komplikaatio, joka voi kehittyä minkä tahansa tekijä VIII-lääkkeen käytön aikana. Etenkin suurina pitoisuuksina esiintyessään nämä inhibiittorit estävät hoitoa vaikuttamasta oikein, ja sinua tai lastasi seurataan huolellisesti inhibiittorien kehittymisen varalta. Kerro lääkärille heti, jos verenvuotosi tai lapsesi verenvuoto ei ole hallittavissa ReFacto AF -valmisteella.
- jos verenvuotosi ei lopu odotetusti, ja ota yhteyttä lääkäriisi tai hakeudu välittömästi ensiapuun.
Muut lääkevalmisteet ja ReFacto AF
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
ReFacto AF -hoidolla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
ReFacto AF sisältää natriumia
Käyttökuntoon valmistettuna ReFacto AF sisältää 1,27 mmol (tai 29 mg) natriumia (ruokasuolan toinen ainesosa) per esitäytetty ruisku. Tämä vastaa 1,5 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle. Voit painosi ja ReFacto AF ‑annostuksen perusteella saada vuorokaudessa useita esitäytettyjä ruiskuja. Tämä on otettava huomioon, jos noudatat vähäsuolaista ruokavaliota.
3. Miten valmistetta käytetään
Ota tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
ReFacto AF -hoidon saa aloittaa vain lääkäri, jolla on kokemusta hemofilia A:ta sairastavien potilaiden hoidosta. Lääkärisi päättää kuinka suuri annos ReFacto AF -valmistetta sinulle annetaan. Annoksen suuruus ja hoidon kesto riippuvat yksilöllisestä tekijä VIII:n korvaushoidon tarpeestasi. ReFacto AF annetaan usean minuutin pituisena injektiona laskimoon. Potilas tai tämän hoitaja voi antaa ReFacto AF -injektioita, jos hän on saanut siihen asianmukaisen koulutuksen.
Hoitosi kuluessa lääkärisi saattaa päättää muuttaa sinulle annettavaa ReFacto AF -valmisteen annosta.
Ota yhteys terveydenhoidon ammattilaiseen ennen matkalle lähtöä. Pidä aina matkoilla mukanasi riittävästi tekijä VIII ‑valmistetta siltä varalta, että tarvitset matkalla hoitoa.
On suositeltavaa, että kirjoitat muistiin pakkauksen päällä olevan valmisteen kauppanimen ja eränumeron joka kerta kun käytät ReFacto AF -valmistetta. Esitäytetyssä ruiskussa on etikettitarra, jota voit käyttää eränumeron kirjaamiseen kalenteriisi tai minkä tahansa haittavaikutuksen raportoimiseen.
Käyttöönvalmistus ja annostelu
Alla mainitut toimenpiteet ovat esitäytetyssä ruiskussa olevan ReFacto AF -valmisteen käyttöönvalmistuksen ja annostelun ohjeita. Potilaiden tulee noudattaa lääkäriensä antamia erityisiä käyttöönvalmistuksen ja annostelun ohjeita.
ReFacto AF annetaan laskimoinfuusiona (i.v.) sen jälkeen kun se on tehty käyttökuntoon. Esitäytetyssä ruiskussa on kaksi kammiota, joista toinen sisältää ReFacto AF ‑kylmäkuivattua injektiokuiva-ainetta ja toinen liuotinta [9 mg/ml (0,9 %) natriumkloridiliuos]. Tässä ohjeessa laitteesta käytetään nimitystä esitäytetty ruisku.
Käytä käyttöönvalmistukseen vain rasiassa olevaa esitäytettyä ruiskua. Annosteluun voidaan käyttää muitakin steriilejä kertakäyttöruiskuja.
ReFacto AF -valmistetta ei saa sekoittaa muihin infuusionesteisiin.
Huom: Jos infuusioon on tarkoitus käyttää useampi kuin yksi ReFacto AF ‑esitäytetty ruisku, jokainen niistä tulee valmistaa käyttökuntoon ohjeiden mukaisesti. Käyttövalmiit liuokset voidaan vetää kustakin ruiskusta käyttämällä yhtä isoa (10 ml tai isompi) luer-lukollista ruiskua (ei sisälly pakkaukseen) (ks. kohta Lisäohjeita).
Valmistaminen
- Pese aina kädet ennen injektionesteen valmistusta ja antoa.
- Käyttökuntoon saattamisessa tulee noudattaa aseptista (puhdasta ja hygienista) tekniikkaa.
- Kaikki valmisteen käyttökuntoon saattamisessa ja annostelussa käytettävät ainesosat tulee käyttää mahdollisimman pian steriilien pakkausten avaamisen jälkeen, jotta ilma-altistus on mahdollisimman lyhyt.
Käyttökuntoon saattaminen
- Anna esitäytetyn ruiskun lämmetä huoneenlämpöiseksi.
- Avaa ReFacto AF ‑esitäytetty ruiskupakkaus ja aseta osat puhtaalle tasolle. Varmista, että kaikki tarvikkeet ovat saatavilla.
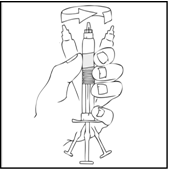
- Tartu männänvarteen kuvan mukaisella tavalla. Työnnä männänvarsi tiukasti kiinni ReFacto AF ‑esitäytetyn ruiskun suuaukkoon kiertämällä myötäpäivään, kunnes tunnet kevyen vastustuksen (noin kaksi kierrosta).
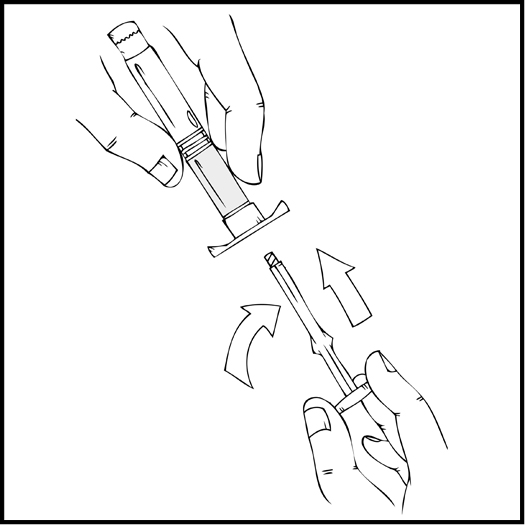
Koko valmistusprosessin ajan ReFacto AF ‑esitäytetty ruisku on pidettävä pystyasennossa (siten että valkoinen injektiokuiva-aine on kirkkaan liuoksen yläpuolella), jotta valmistetta ei vuotaisi.
- Pidä esitäytetty ruisku pystyasennossa ja väännä valkoista sinettiä oikealta vasemmalle (tai murra se varovasti), jolloin korkin lävistys katkeaa ja alta paljastuu ReFacto AF ‑esitäytetyn ruiskun harmaa kuminen kärkikorkki.
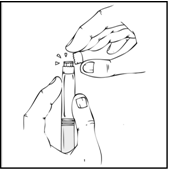
- Poista sininen venttiilikorkki pakkauksestaan.
Pidä edelleen ReFacto AF ‑esitäytetty ruisku pystyasennossa ja korvaa harmaa kuminen kärkikorkki sinisellä venttiilikorkilla. Venttiilikorkissa on pieniä reikiä, joista ilma pääsee ulos estäen paineen muodostumista. Vältä koskettamasta ruiskun avointa päätä tai sinistä venttiilikorkkia.
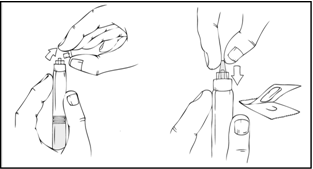
- Paina hitaasti ja varovasti männänvartta, kunnes esitäytetyn ruiskun sisällä olevat kaksi mäntää kohtaavat, jolloin liuotin kulkeutuu ReFacto AF ‑injektiokuiva-ainetta sisältävään yläkammioon.
Huom. Älä paina männänvartta liian voimakkaasti, jotta neste ei tule ulos ruiskun kärjestä.
- Pidä edelleen ReFacto AF ‑esitäytetty ruisku pystyasennossa ja pyöritä ruiskua varovasti useita kertoja, kunnes kuiva-aine on liuennut.
Tarkista lopullinen liuos hiukkasten ja värimuutosten varalta. Liuoksen tulee olla kirkasta tai hieman sameaa ja väritöntä. Esitäytetty ruisku on hävitettävä, jos liuoksessa havaitaan hiukkasia tai värimuutoksia.
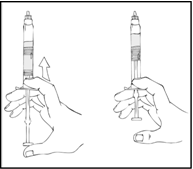
- Pidä edelleen ReFacto AF ‑esitäytetty ruisku pystyasennossa ja paina hitaasti männänvartta, kunnes lähes kaikki ilma on poistunut (ylä)kammiosta.
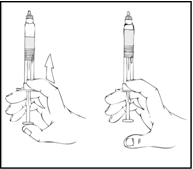
ReFacto AF on infusoitava 3 tunnin kuluessa valmistamisesta tai esitäytetyn ruiskun harmaan kärkikorkin poistamisesta.
Jos et käytä ReFacto AF ‑liuosta heti, säilytä ruisku pystyasennossa sinisellä venttiilikorkilla suljettuna, kunnes olet valmis käyttämään liuoksen. Käyttökuntoon saatettu liuos säilyy huoneenlämmössä enintään kolme tuntia. Jos et ole käyttänyt liuosta kolmen tunnin kuluessa, hävitä se.
Annostelu (laskimoinfuusio)
Lääkäri tai hoitohenkilökunta opastaa sinulle oikean ReFacto AF -valmisteen käytön. Kun opit annostelemaan lääkkeen itse, voit seurata tämän pakkausselosteen ohjeita.
ReFacto AF annostellaan infuusiona laskimoon (i.v.) sen jälkeen kun se on tehty käyttökuntoon sekoittamalla injektiokuiva-aine ja liuotin [9 mg/ml (0,9 %) natriumkloridiliuos]. Käyttökuntoon saattamisen jälkeen ReFacto AF on tarkistettava hiukkasten ja värimuutosten varalta ennen antoa.
ReFacto AF tulee antaa käyttämällä tähän pakkaukseen kuuluvia infuusiovälineitä, ellei lääkäri tai hoitohenkilökunta toisin opasta.
- Poista sininen venttiilikorkki ja kiinnitä infuusioletkusto ReFacto AF ‑esitäytettyyn ruiskuun.
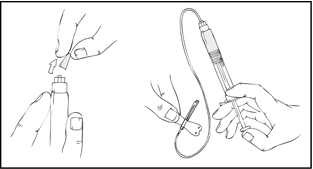
- Käytä kiristyssidettä ja valmistele injektiopaikka pyyhkimällä iho pakkauksessa mukana olevalla alkoholitupolla perusteellisesti.
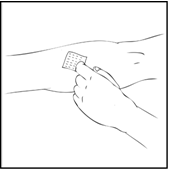
- Poista neulan suojus ja laita infuusioletkustossa oleva siipineula laskimoon lääkärisi ohjeiden mukaisesti. Poista kiristysside. Käyttökuntoon saatettu ReFacto AF injisoidaan laskimonsisäisesti usean minuutin aikana. Lääkärisi saattaa muuttaa sinulle suositeltua infuusionopeutta, jos infuusio tuntuu epämukavalta. Keskustele laskimoinjektioiden antamisesta lääkärin tai hoitohenkilökunnan kanssa. Älä yritä annostella lääkettä itse, jos et ole saanut siihen opastusta.
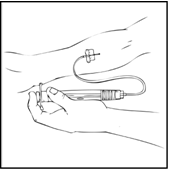
Käyttökuntoon saatettua ReFacto AF ‑liuosta ei saa sekoittaa tai antaa saman infuusiolaitteiston kautta muiden lääkevalmisteiden kanssa.
- Kun olet annostellut ReFacto AF -liuoksen, irrota infuusiovälineet ja hävitä ne. Infuusiovälineisiin jäävällä lääkemäärällä ei ole merkitystä hoidon kannalta.
Huom. Hävitä kaikki käyttämättä jäänyt liuos, tyhjä esitäytetty ruisku sekä käytetyt välineet asianmukaiseen, lääketieteellisen jätteen hävittämiseen tarkoitettuun säiliöön, sillä nämä materiaalit saattavat vahingoittaa muita, jos niitä ei ole kunnolla hävitetty.
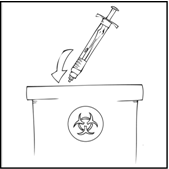
On suositeltavaa, että kirjoitat muistiin valmisteen pakkauksen päällä olevan eränumeron joka kerta kun käytät ReFacto AF -valmistetta. Esitäytetyssä ruiskussa on etikettitarra, jota voit käyttää eränumeron kirjaamiseen.
Lisäohjeita:
Useampien ReFacto AF ‑esitäytettyjen ruiskujen valmistaminen käyttämällä yhtä isoa (10 ml tai isompi) luer-lukollista ruiskua (ei sisälly pakkaukseen)
Alla olevat ohjeet koskevat useampien ReFacto AF ‑esitäytettyjen ruiskujen valmistamista käyttämällä yhtä isoa (10 ml tai isompi) luer-lukollista ruiskua.
- Valmista kaikki ReFacto AF ‑esitäytetyt ruiskut yllä olevien käyttökuntoon saattamista koskevien ohjeiden mukaisesti (ks. Käyttöönvalmistus ja annostelu).
Pidä ReFacto AF ‑esitäytetty ruisku pystyasennossa ja paina hitaasti männänvartta, kunnes lähes kaikki ilma on poistunut lääkeainekammiosta.
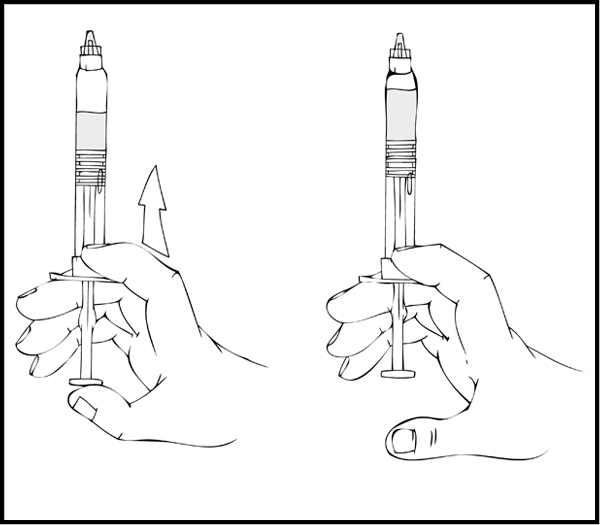
- Poista ruiskuliitin (luer-to-luer) kuorestaan (ei sisälly pakkaukseen).
- Liitä steriili 10 ml:n (tai isompi) luer-lukollinen ruisku ruiskuliittimen suuaukkoon (porttiin) ja ReFacto AF ‑esitäytetty ruisku vastapäiseen porttiin.
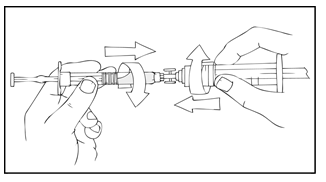
- Pidä ReFacto AF ‑esitäytetty ruisku päällimmäisenä ja paina männänvartta hitaasti, kunnes koko sisältö on valunut 10 ml:n (tai isompi) luer-lukolliseen ruiskuun.
- Irrota tyhjä ReFacto AF ‑esitäytetty ruisku ja toista yllä olevat kohdat Miten valmistetta käytetään ja Mahdolliset haittavaikutukset muille käyttökuntoon saatetuille ruiskuille.
- Irrota ruiskuliitin (luer-to-luer) 10 ml:n (tai isompi) luer-lukollisesta ruiskusta ja kiinnitä infuusioletkusto aiemmin mainittujen annostelua koskevien ohjeiden mukaisesti [ks. Annostelu (Laskimoinfuusio)].
Huom. Hävitä kaikki käyttämättä jäänyt liuos, tyhjä esitäytetty ruisku sekä käytetyt välineet asianmukaiseen, lääketieteellisen jätteen hävittämiseen tarkoitettuun säiliöön, sillä nämä materiaalit saattavat vahingoittaa muita, jos niitä ei ole kunnolla hävitetty.
Jos käytät enemmän ReFacto AF -valmistetta kuin sinun pitäisi
Tarkista annostusohjeet lääkäriltä tai apteekista, jos olet epävarma.
Jos lopetat ReFacto AF -valmisteen käytön
Älä lopeta ReFacto AF -valmisteen käyttämistä ennen kuin olet keskustellut lääkärisi kanssa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Allergiset reaktiot
Jos vakavia, äkillisiä allergisia (anafylaktisia) reaktioita ilmaantuu, infuusion anto täytyy lopettaa välittömästi. Sinun on otettava yhteyttä lääkäriisi välittömästi, jos sinulla esiintyy mitä tahansa seuraavista, varhaisista allergisten reaktioiden merkeistä:
- ihottuma, nokkosihottuma, paukamat, yleistynyt kutina
- huulten ja kielen turpoaminen
- hengitysvaikeudet, hengityksen vinkuna, puristava tunne rinnassa
- yleinen huonon olon tunne
- heitehuimaus ja tajunnan menetys
Vakavat oireet, kuten hengitysvaikeudet ja (lähes) pyörtyminen, vaativat välitöntä hoitoa. Vakavat, äkilliset allergiset (anafylaktiset) reaktiot ovat melko harvinaisia (voivat ilmaantua enintään 1 käyttäjälle 100:sta).
Inhibiittorien kehittyminen
Lapsille, jotka eivät ole aiemmin saaneet tekijä VIII -lääkkeitä, kehittyy hyvin yleisesti (yli yhdellä potilaalla 10:stä) inhibiittoreita eli vasta-aineita (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä). Riski on kuitenkin melko harvinainen (alle yhdellä potilaalla 100:sta), jos potilas on saanut aiemmin tekijä VIII -hoitoa (yli 150 hoitopäivää). Tällöin lääkityksesi tai lapsesi lääkitys voi lakata vaikuttamasta oikein, ja sinulla tai lapsellasi voi esiintyä jatkuvaa verenvuotoa. Jos näin käy, lääkäriin on otettava heti yhteyttä.
Hyvin yleiset haittavaikutukset (voi ilmaantua useammalle kuin 1 käyttäjälle kymmenestä)
- vasta-aineiden kehittyminen potilaille, joita ei ole koskaan aiemmin hoidettu hyytymistekijä VIII -valmisteilla
- päänsärky
- yskä
- nivelkipu
- kuume.
Yleiset haittavaikutukset (voi ilmaantua enintään 1 käyttäjälle kymmenestä)
- verenvuoto
- heitehuimaus
- heikentynyt ruokahalu, ripuli, oksentelu, vatsakipu, pahoinvointi
- nokkosihottuma, kutina, ihottuma
- lihaskipu
- vilunväreet, reaktio katetrin pistoskohdassa
- tietyt verikokeet voivat antaa viitteitä tekijä VIII:aa vastaan tuotettujen vasta-aineiden lisääntymisestä.
Melko harvinaiset haittavaikutukset (voi ilmaantua enintään 1 käyttäjälle sadasta)
- vasta-aineiden kehittyminen potilaille, joita on aiemmin hoidettu hyytymistekijä VIII –valmisteilla (alle 1 käyttäjälle sadasta)
- vaikea allerginen reaktio
- tunnottomuus, uneliaisuus, makuaistin muutokset
- rintakipu, sydämen tiheälyöntisyys, sydämen tykytys
- alhainen verenpaine, veritulppaan liittyvä kipu ja punoitus verisuonissa, punastelu
- hengenahdistus
- liikahikoilu
- heikkous, pistoskohdan reaktiot mukaan lukien kipu
- sydänentsyymiarvojen lievä suureneminen
- maksaentsyymiarvojen suureneminen, bilirubiiniarvojen suureneminen.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa ja esitäytetyn ruiskun myyntipäällysmerkinnöissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä ja kuljeta kylmässä (2 °C–8 °C). Ei saa jäätyä, jotta esitäytetty ruisku ei vahingoitu.
Käyttömukavuuden vuoksi lääkevalmiste voidaan siirtää kertaalleen korkeintaan 3 kuukauden ajaksi huoneenlämpöön (alle 25 °C). Tämän huoneenlämmössä säilytysajanjakson lopussa tuotetta ei saa laittaa takaisin kylmäsäilytykseen, vaan se on hävitettävä. Kirjoita muistiin ulkopakkaukseen se päivämäärä, jolloin ReFacto AF poistettiin kylmäsäilytyksestä ja laitettiin huoneenlämpöön (alle 25 °C). Valolta suojaamiseksi säilytä esitäytetty ruisku ulkopakkauksessa.
Käytä valmistettu liuos 3 tunnin kuluessa valmistamisesta tai harmaan kärkikorkin poistamisesta.
Liuos on kirkas tai hiukan samea ja hajuton. Älä käytä tätä lääkettä, jos huomaat että se on sameaa tai siinä näkyy hiukkasia.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä ReFacto AF sisältää
- Vaikuttava aine on moroktokogi alfa (rekombinantti hyytymistekijä VIII). Kukin ReFacto AF -esitäytetty ruisku sisältää 250, 500, 1000, 2000 tai 3000 IU moroktokogi alfaa.
- Esitäytetyssä ruiskussa on mukana myös liuotin [9 mg/ml (0,9 %) natriumkloridiliuos] moroktokogi alfan käyttökuntoon saattamista varten.
- Muut aineet ovat sakkaroosi, kalsiumklorididihydraatti, L-histidiini, polysorbaatti 80 ja natriumkloridi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ReFacto AF sisältää natriumia).
- Mukana olevan liuottimen [natriumkloridiliuos 9 mg/ml (0,9 %)] lisäämisen jälkeen valmis injektioliuos sisältää 62,5, 125, 250, 500 tai 750 IU (perustuen moroktokogi alfan vahvuuteen, so. 250, 500, 1000, 2000 tai 3000 IU) moroktokogi alfaa/1 ml valmistettua injektioliuosta.
Lääkevalmisteen kuvaus ja pakkauskoot
ReFacto AF toimitetaan injektiokuiva-aineena ja liuottimena, liuosta varten, esitäytetyssä ruiskussa. Ruiskun yläkammio sisältää ReFacto AF ‑injektiokuiva-aineen ja alakammio liuottimen [9 mg/ml (0,9 %) natriumkloridiliuos].
Pakkauksen sisältö:
- 1 esitäytetty ruisku sisältää moroktokogi alfaa 250, 500, 1000, 2000 tai 3000 IU kuiva-ainetta ja 4 ml liuotinta [steriili 9 mg/ml (0,9 %) natriumkloridiliuos] käyttökuntoon saattamista varten.
- 1 männänvarsi
- 1 steriili venttiilikorkki
- 1 steriili infuusiosetti
- 2 alkoholipyyhettä
- 1 laastari
- 1 harsotaitos
Myyntiluvan haltija
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Belgia
Valmistaja
Wyeth Farma S.A.
Autovia del Norte A-1 Km 23
Desvio Algete Km 1
28700 San Sebastian de los Reyes
Madrid
Espanja
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 43 00 40
Tämä pakkausseloste on tarkistettu viimeksi 02/2025.
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu.