Curosurf® 80 mg/ml, instillaatiosuspensio hengitysteihin
sian keuhkon lipidit ja proteiinit
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Curosurf on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Curosurf-valmistetta
- Miten Curosurf-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Curosurf-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
Curosurf on steriili neste (suspensio) injektiopullossa. Yksi pullo sisältää 120 mg tai 240 mg sian keuhkolipidejä.
Curosurf-valmistetta käytetään ennenaikaisesti syntyneiden lasten hoitoon, jos lapsella on vastasyntyneen hengitysvaikeusoireyhtymä (RDS) tai sen riski.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Curosurf-valmistetta
- jos olet allerginen sian keuhkon lipideille tai proteiineille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Curosurf-valmisteen antamista munuaisten tai maksan vajaatoimintaa sairastaville ennenaikaisesti syntyneille lapsille ei ole tutkittu.
Muut lääkevalmisteet ja Curosurf
Ei ole tiedossa, vaikuttaako Curosurf-valmisteen käyttö muiden lääkkeiden käyttöön tai vaikuttaako muiden lääkkeiden käyttö sen käyttöön.
Curosurf sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
3. Miten valmistetta käytetään
Curosurf-valmistetta saa antaa vain henkilö, joka on saanut koulutuksen keskosten hoitoon, elvytykseen ja tilan stabilointiin ja jolla on kokemusta näistä. Annos määritetään lapsen painon mukaan ja annoksen suuruus riippuu siitä, käytetäänkö valmistetta hengitysvaikeusoireyhtymän ehkäisyyn vai hoitoon.
Mitä tehdä jos Curosurf-valmistetta annetaan enemmän kuin pitäisi
Yliannostustapauksia ei ole raportoitu Curosurf-valmisteen käytön yhteydessä.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai sairaanhoitajan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Kliinisissä tutkimuksissa annetun hoidon aikana havaitut haittavaikutukset ja valmisteen markkinoille tulon jälkeen raportoidut haittavaikutukset on lueteltu alla olevassa taulukossa MeDRA:n elinluokkajärjestelmän mukaisesti. Taulukossa käytetyt esiintymistiheydet ovat: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1000, < 1/100), harvinainen (≥ 1/10 000, < 1/1000), hyvin harvinainen (< 1/10 000), esiintymistiheys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| Elinluokka |
Haittavaikutus |
Esiintymistiheys |
| Infektiot |
Sepsis |
Melko harvinainen |
| Hermosto |
Kallonsisäinen verenvuoto |
Melko harvinainen |
| Sydän |
Bradykardia |
Harvinainen |
| Verisuonisto |
Hypotensio |
Harvinainen |
| Hengityselimet, rintakehä ja välikarsina |
Bronkopulmonaalinen dysplasia |
Harvinainen |
| Ilmarinta |
Melko harvinainen |
| Keuhkoverenvuoto |
Harvinainen |
| Hyperoksia |
Tuntematon |
| Neonataalinen syanoosi |
Tuntematon |
| Apnea |
Tuntematon |
| Tutkimukset |
Happisaturaation väheneminen |
Harvinainen |
| Epänormaali aivosähkökäyrä |
Tuntematon |
| Vammat ja myrkytykset |
Intuboinnin komplikaatio |
Tuntematon |
Yllä mainittuja komplikaatioita voi esiintyä keskosuuden seurauksena.
Kun Curosurf-valmistetta on annettu ohuella katetrilla, on havaittu joitakin lieviä ja ohimeneviä haittavaikutuksia: bradykardia (sydämen hidaslyöntisyys), apnea (hengityskatko), pienentynyt happisaturaatio, vaahtoa suussa, yskiminen, hengitysteiden tukkeutuminen ja aivastelu.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan kansallisen ilmoitusjärjestelmän kautta:
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Curosurf-valmistetta on saatavana käyttövalmiina injektiopulloina. Säilytä alkuperäispakkauksessa. Herkkä valolle. Säilytä jääkaapissa (2oC - 8oC). Ensimmäisen annon jälkeen ylijäänyttä määrää ei saa käyttää.
Avaamattomat, käyttämättömät Curosurf-injektiopullot, jotka on lämmitetty huoneenlämpöisiksi, voidaan palauttaa jääkaappiin 24 tunnin kuluessa tulevaa käyttöä varten. Injektiopullon saa lämmittää huoneenlämpöiseksi ja palauttaa jääkaappiin vain kerran.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Älä käytä tätä lääkettä, jos huomaat näkyviä muutoksia lääkevalmisteen ulkonäössä.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Curosurf sisältää
- Vaikuttavat aineet ovat sian keuhkon lipidit ja proteiinit.
- Muut aineet ovat natriumkloridi, natriumvetykarbonaatti (pH:n säätöön) ja injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoot
Valkoinen tai keltainen steriili suspensio.
1 x 1,5 ml ja 1 x 3 ml, kirkas, väritön injektiopullo, muovi- ja alumiinikorkki sekä kumitulppa.
Myyntiluvan haltija
Chiesi Farmaceutici S.p.A., via Palermo 26/A, 43122 Parma, Italia
Valmistaja
Chiesi Farmaceutici S.p.A., Via Palermo 26/A, 43122 Parma, Italia
tai
Chiesi Farmaceutici S.p.A., Via San Leonardo 96, 43122 Parma, Italila
Tämä pakkausseloste on tarkistettu viimeksi 10.04.2018
Ohjeet terveydenhuollon ammattilaiselle
Curosurf-valmistetta saa antaa vai henkilö, joka on saanut koulutuksen keskosten hoitoon, elvytykseen ja tilan stabilointiin ja jolla on kokemusta näistä, ja vain sillä edellytyksellä, että käytettävissä on hengitysvaikeusoireyhtymää sairastavan lapsen ventilaatioon ja valvontaan tarvittavat välineet.
Profylaktinen käyttö: Kerta-annos 1,25–2,50 ml/kg (100–200 mg/kg) tulisi antaa heti synnytyksen jälkeen niin pian kuin mahdollista, kuitenkin mieluiten 15 minuutin sisällä. Lisäannos 1,25 ml/kg (100 mg/kg) voidaan antaa 6–12 tunnin kuluttua ensimmäisestä annoksesta ja edelleen 12 tunnin kuluttua niille lapsille, joilla on jatkuvia hengitysvaikeusoireyhtymän oireita ja jotka ovat hengityslaitteesta riippuvaisia. (Kokonaisannos maksimissaan 3,75–5,0 ml/kg eli 300–400 mg/kg.)
Hengitysvaikeusoireyhtymä: Hoito olisi aloitettava välittömästi RDS-diagnoosin varmistuttua. Curosurf annetaan kerta-annoksena 1,25–2,5 ml/kg (100–200 mg/kg) intratrakeaalisesti. Toinen ja kolmas samansuuruinen annos voidaan antaa 12 ja 24 tunnin kuluttua edellä kuvatulla tavalla (kokonaisannos maksimissaan 300–400 mg/kg).
Lääkkeen anto: Liuospullo lämmitetään huoneenlämpöiseksi ennen käyttöä. Pulloa käännellään varovasti ylösalaisin, mutta ei ravisteta, jotta saadaan aikaan tasainen suspensio. Vaahdonmuodostusta on vältettävä.
Suspensio vedetään injektiopullosta pois steriilillä neulalla ja ruiskulla.
Ota suspensio injektiopullosta alla olevien ohjeiden mukaisesti:
1) Etsi värillisestä muovikorkista lovi (NOSTA ↑ YLÖS).
2) Nosta lovea ja vedä ylöspäin.
3) Vedä muovikorkkia ja sen alumiinista osaa alaspäin
4) ja 5) poista koko rengas vetämällä alumiininen päällys pois
6) ja 7) poista kumitulppa, jotta pääset käsiksi injektiopullon sisältöön.
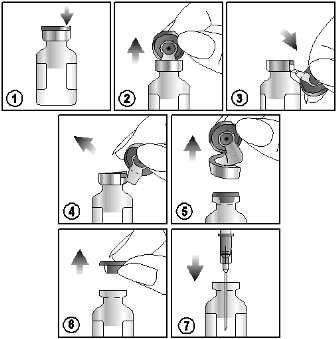
Kertakäyttöinen. Hävitä käyttämättä jäänyt tuote. Älä säilytä käyttämättä jäänyttä lääkettä myöhempää käyttöä varten.
Käyttämättä jäänyt tuote ja jätteet pitää hävittää paikallisten suositusten mukaisesti.
Curosurf voidaan antaa seuraavia eri menetelmiä käyttäen: Intubaatioputken kautta: Lääke voidaan antaa lapsen ollessa kytkettynä respiraattoriin tai irrotettuna respiraattorista. Lääke voidaan tarvittaessa antaa myös synnytyshuoneessa intubaatioputken kautta ennen mekaanisen (käsi)ventilaation aloittamista. Lapsen hengitystiet on imettävä puhtaaksi ennen lääkkeen antoa. Lapsi asetetaan selälleen. Curosurf annetaan katetrin avulla, jonka pituus säädetään yksilöllisesti siten, että kärki osuu lapsen carinan yläpuolelle. Curosurf annetaan 2-3 sekunnin aikana. Tämän jälkeen lapsi kytketään uudelleen respiraattoriin (jos lapsi oli irrotettuna respiraattorista lääkkeen annon ajan) samalla happikonsentraatiolla kuin ennen lääkkeen antoa. Respiraattori on säädettävä kliinisen vasteen mukaan lääkkeen annon jälkeen. Vaikutus näkyy noin 5 minuutissa. Hengitysteitä ei saa imeä ainakaan 6 tuntiin annon jälkeen, ellei kyseessä ole henkeä uhkaava tilanne.
Vähemmän invasiivinen surfaktantin annostelu ohuella katetrilla (LISA): Spontaanisti hengittäville ennenaikaisesti syntyneille lapsille voidaan annostella Curosurf-valmistetta vähemmän invasiivisella surfaktantin annostelutekniikalla ohutta katetria käyttäen. Annokset ovat samat kuin on esitetty edellä. Pieniläpimittainen katetri asetetaan lapsen henkitorveen niin, että laryngoskoopin avulla on näköyhteys äänihuuliin. Lapsi on tällöin kytkettynä CPAP-laitteeseen, jolloin varmistetaan jatkuva spontaani hengitys. Curosurf annetaan kertaboluksena 0,5–3 minuutin aikana. Curosurf-valmisteen annon jälkeen katetri poistetaan välittömästi. CPAP-hoitoa on jatkettava koko toimenpiteen ajan. Surfaktantin antoon on käytettävä tähän käyttötarkoitukseen CE-merkittyjä ohuita katetreja.
Kokemukset pitkäaikaisesta seurannasta ovat vähäisiä. Lisätietoja saat hyväksytystä valmisteyhteenvedosta.